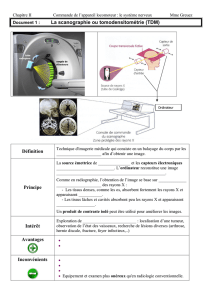
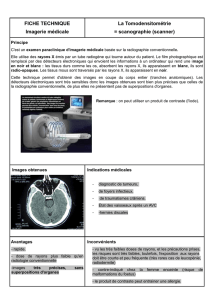
notes de cours

1
COURS 2 : IMAGERIE MÉDICALE
INTRODUCTION
L’imagerie médicale regroupe les moyens d’acquisition et de restitution d’images sur la base
de plusieurs phénomènes physiques tels que la résonance magnétique, la radioactivité,
l’absorption/atténuations des rayons X, la réflexion d’ondes d’ultrasons, l’effet
photoélectrique, etc.
NOTIONS DE BASE EN IMAGERIE: L’ATOME ET LE RAYONNEMENT
L’ATOME
L’atome est la plus petite division d’un élément dans lequel l’identité chimique est maintenue.
Il est composé d’un noyau dense, chargé positivement qui contient des protons et des
neutrons et un nuage extranucléique d’électrons chargés négativement. Dans un état non-
ionisé, l’atome compte autant de charges positives que négatives.
Dans le modèle de Bohr, (Niels Bohr, 1913) les orbites des électrons sont à distance fixe du
noyau. Chaque électron occupe un état d’énergie fixe, ce qui confère à l’atome des couches
électroniques auxquelles on assigne les lettres K, L, M, N, O, P, ou la couche K est la plus
profonde (la plus proche au noyau). Les couches ont également un nombre quantique « n » qui
prend les valeurs 1, 2, 3, 4, etc., pour K, L, M, etc., respectivement. Chaque couche ne peut
contenir que 2n2 électrons. Donc, la couche K (n=1) ne peut contenir que deux électrons, la
couche L (n=2) peut en contenir 2 (2)2= 8, etc.
Figure 1: Modèlel de Bohr. Exemplification avec l’atome de chlore (17 électrons)
Source : http://www.resume-de-chimie.com/atome.htm
Le noyau de l’atome est composé de neutrons (éléments sans charge électrique) et de protons
(éléments de charge électrique positive). Le nombre de protons correspond au numéro
atomique Z et le nombre de protons et de neutrons dans un noyau correspond au nombre de

2
masse A (à ne pas confondre avec la masse atomique qui correspond à la masse de l’atome au
complet). À titre d’exemple, le nombre de masse A de l’oxygène-16 est 16 (8 neutrons et 8
protons) alors que la masse atomique est 15.9949amu.
La notation est habituellement la suivante: AZXN. Dans cette notation, Z et X sont redondants
puisque le nombre de protons est généralement contenu dans le nom chimique (H,
Hydrogène, correspond à Z=1, He, Hélium, correspond à Z=2, et ainsi de suite, en suivant le
tableau périodique). Le nombre de protons est calculé par N=A (nombre de masse) – Z
(nombre de protons). La charge de l’atome est donnée par un exposant à droite.
Dans le noyau, il existe une force nommée force nucléaire. Une force autre qu'électrostatique
ou électromagnétique s'exerçant entre nucléons (éléments du noyau) et qui assure la cohésion
du propre noyau. Une telle force est essentiellement attractive et à très court rayon d'action.
Un atome (même un ion ou une molécule en général) a un niveau d’énergie associé. Le niveau
d’énergie est un état quantique stationnaire équivalent à une énergie interne particulière.
Cette énergie s'exprime souvent en électronvolts mais, de préférence, en kilojoules par mole
(unités du système international).
ÉNERGIE DE LIAISON
L’énergie nécessaire pour retirer un électron complètement de l’atome est appelée énergie de
liaison. Par convention, les énergies de liaison sont négatives et augmentent avec la proximité
de la couche au noyau. Pour qu’un atome puisse s’ioniser, c'est-à-dire pour qu’il devienne
chargé électriquement, on a besoin d’un transfert énergétique équivalent ou supérieur à son
énergie de liaison. Cette énergie peut être donnée par un photon ou une forme corpusculaire
d’une radiation ionisante. L’énergie de liaison augmente avec le nombre de protons dans le
noyau et dépend donc du nombre atomique (Z). Dans l’exemple cité ci-dessous, l’électron de
la couche K du tungstène est beaucoup plus fortement lié à l’atome que l’électron de la couche
K de l’atome d’hydrogène.
Figure 2 : Variation du niveau énergétique de liaison selon le nombre atomique (Z)
Source : JT Bushberg et al., 2002 ,p.22.

3
CASCADE DES ÉLECTRONS
Lorsqu’un électron est retiré de sa couche par un photon X ou gamma, il subsiste une lacune
dans la couche. Cette lacune est généralement remplie par un électron provenant d’une
couche supérieure, qui lui-même est remplacé par un électron d’une couche supérieure et
ainsi de suite. C’est ce qu’on appelle la cascade d’électrons. L’énergie libérée est équivalente à
la différence d’énergie de liaison entre la couche d’origine et la couche finale de l’électron.
Cette énergie est libérée sous forme de rayons X (figure 3) ou d’électrons Auger (figure 4).
Figure 3 : Énergie libérée sous forme de rayons X
Figure 4 : Énergie libérée sous forme d’électrons Auger
Source : JT Bushberg et al., 2002, p.23.
Une transition de la couche M à la couche K d’un atome de Tungstène produirait un rayon X de
E(K ) = EK-EM = 69.5keV – 2.5keV = 67keV. L’énergie de liaison étant « E ».
RADIOACTIVITÉ
Seules certaines combinaisons de neutrons et de protons sont stables. Les atomes possédant
un nombre impair de neutrons, un nombre impair de protons et une masse atomique élevée
ont tendance à être instables. Par contre, avec le temps, ces noyaux instables vont aller vers
un état stable.
Il existe deux types d’instabilité, l’excès de neutrons et le déficit de neutrons. Ce type de noyau
a un excès d’énergie comparé aux noyaux ou il n’y a pas ces déséquilibres. L’équilibre est
néanmoins atteint par conversion d’un neutron vers un proton ou vice versa et cette
conversion s’accompagne d’émission d’énergie. Cette émission d’énergie inclut des particules
et des radiations. Les noyaux qui se transforment d’un état instable à un état stable sont dits
radioactifs et le processus de transformation est appelé décroissance radioactive. Cette
décroissance radioactive peut passer par différents stades avant d’atteindre un atome stable.
Par exemple, l’uranium-238 (isotope de l’uranium avec un nombre de masse équivalent a 238)
subit 14 transformations avant d’atteindre un état stable qui est le plomb-206 (isotope du
plomb avec un nombre de masse de 238). On parle de noyau précurseur (celui qui mène à la

4
radioactivité et qui est toujours instable) et de noyau engendré (celui ayant subi la
décroissance radioactive et qui peut être instable ou stable).
La décroissance radioactive d’un atome radioactif forme généralement un noyau engendré
dans un état excité. La radiation électromagnétique qui est émise par le noyau qui passe d’un
état d’énergie supérieur à un état d’énergie inférieur est appelée rayon gamma. Cette
transition est analogue à l’émission de rayons X lors d’une ionisation d’atomes. Mais comme
l’énergie nécessaire à rééquilibrer l’énergie dans un noyau est beaucoup plus importante, les
rayons gamma sont généralement beaucoup plus énergétiques que les rayons X.
Il existe une autre méthode lorsque la désexcitation ne se fait pas par émission de
rayonnement gamma : la conversion interne. Ce processus de désexcitation se fait par
transfert orbital d’électrons. L’électron est éjecté de l’atome avec l’énergie cinétique
équivalente au rayonnement gamma moins l’énergie de liaison.
INTERACTION DE PARTICULES AVEC LA MATIÈRE
Il faut différencier le comportement des particules lourdes avec celui des particules légères.
D’un côté, on entend par « lourdes » les particules beaucoup plus lourdes que les électrons,
c’est-à-dire toutes les particules à l’exception des électrons eux-mêmes puis des positrons
(même masse que l’électron mais avec une charge électrique positive). Pour ce genre de
particules, la perte d’énergie est dominée par leur interaction électromagnétique avec les
électrons atomiques : processus d’excitation et d’ionisation.
D’un autre côté, la perte d’énergie des particules légères (électrons et positrons) est détectée
principalement grâce à l’observation de la perte d’énergie par rayonnement (processus
expliqué ci-dessous).
Une autre distinction importante entre des particules légères et lourdes est leur cheminement
dans la matière. Les électrons suivent des chemins tortueux, résultat de la diffusion causée
par l’attraction ou la répulsion coulombienne. Par contre, les particules plus lourdes ont un
cheminement plus direct. On peut voir ce phénomène dans la figure 5 suivante.
Figure 5. Cheminement dans la matière. L’électron à gauche et le photon
alpha particule lourde à droite.
Source : JT Bushberg et al., 2002, p. 34.

5
L’excitation est le transfert d’une partie de l’énergie de la particule incidente vers des
électrons dans le matériau absorbant. L’énergie ne dépasse pas l’énergie de liaison de
l’électron. Suite à l’excitation, l’électron va retourner vers un niveau d’énergie plus bas en
émettant des radiations électromagnétiques ou des électrons Auger. Ce phénomène est
montré dans la figure 6.
Lorsque l’énergie transférée dépasse l’énergie de liaison, il y a alors ionisation et un électron
est éjecté de l’atome (voir figure 7). Le résultat est un atome chargé positivement. Parfois, les
électrons ainsi éjectés possèdent suffisamment d’énergie pour engendrer une autre ionisation
appelée ionisation secondaire.
Figure 7. Processus d’ionisation
Source : JT Bushberg et al., 2002, p. 32.
Figure 6. Processus d’excitation
Source : JT Bushberg et al., 2002, p. 32.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%