DS5 bis

NOM :
Prénom : TS3 DS de remplacement du 30 janvier 2006
Exercice n°1 : Etude d’un flash d’appareil photo
On se propose d'étudier le fonctionnement d'un flash d'appareil photographique jetable. Pour obtenir un éclair de puissance
lumineuse suffisante, on utilise un tube flash qui nécessite pour son amorçage, une forte tension (au moins 250 V) pour émettre un
éclair très bref. Pour stocker l'énergie nécessaire au fonctionnement du tube flash, on utilise un condensateur de capacité C. Ce
condensateur est chargé à l'aide d'un circuit électronique alimenté par une pile.
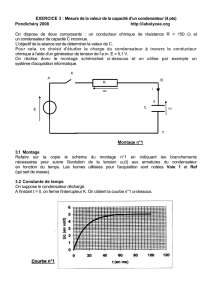
On schématise le fonctionnement de ce dispositif sur le schéma ci-dessous :
l'alimentation est assurée par une pile de tension continue U1 = 1,50 V;
un circuit électronique permettant d'élever la tension U1 à une tension continue U2 = 300 V.
un conducteur ohmique de résistance R = 1,00 k permettant la charge du condensateur de capacité C = 150 F en plaçant
l'interrupteur K2 en position 1 et en fermant l'interrupteur K1.
le tube flash qui est déclenché (une fois le condensateur chargé) en basculant l'interrupteur K2 en position 2.
1. Charge du condensateur :
On charge le condensateur en fermant l'interrupteur K1.
1.1. On donne l'expression de la constante de temps
= RC Vérifier par analyse dimensionnelle l'homogénéité de cette formule.
1.2. Calculer numériquement .
1.3. Calculer l'énergie emmagasinée E par le condensateur de capacité C une fois la charge terminée à la tension U2.
1.4. En calculant l'énergie E' qu'aurait stockée le condensateur s'il avait été chargé directement à l'aide de la pile (tension U1),
justifier l'intérêt de charger le condensateur avec une haute tension de 300 V.
2. Décharge.
En plaçant l'interrupteur inverseur K2 sur la position 2 on provoque le flash grâce à l'énergie stockée dans le condensateur.
On enregistre la tension u aux bornes du condensateur C (voir graphique).
2.1. Comparaison entre temps de charge et temps de décharge.
2.1.1. Déterminer graphiquement la constante de temps ' correspondant à la décharge en précisant la méthode employée.
2.1.2. Comparer les constantes de charge et de décharge '. Ce constat est-il en accord avec les conditions de
fonctionnement du tube flash ?
2.2. On assimilera, après son amorçage, le tube flash à un conducteur ohmique de résistance r. À partir du schéma électrique ci-
contre montrer que l'équation différentielle de la décharge du condensateur à travers un conducteur ohmique de résistance r est de la
forme :
u
Crdt
du .
.
1
= 0
2.3. Vérifier que la solution est de la forme u = U0 exp ( -t / ' )
2.4. Que représente la tension U0 pour le fonctionnement du tube flash ?
2.5. Déterminer U0. Cette valeur est-elle en accord avec la production de l'éclair ?
Exercice n°2 : Bobine
Cet exercice tend à montrer la validité du modèle pour un circuit électrique mettant en jeu une bobine d'inductance L et de résistance
r = 11,8 ,(donc non négligeable), et un conducteur ohmique de résistance R = 12 , alimenté par un générateur délivrant une
tension continue E = 6,1 V.
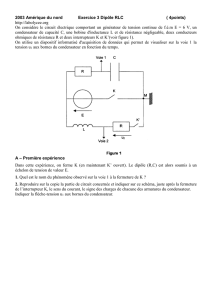
On réalise expérimentalement le circuit électrique ci-contre. L'évolution des grandeurs variables, tension u(t) et intensité i(t), est
obtenue par voie informatique. La voie EA0 permet de visualiser la tension E. La voie EAl permet de visualiser la tension UBC

1. Étude expérimentale
Le montage expérimental et la courbe donnant l'évolution de l'intensité i(t), obtenue par traitement informatique sont donnée.
1.1. Évaluer graphiquement la durée du régime transitoire. Aucune justification n'est demandée.
1.2. étant la constante de temps associée au dipôle {bobine-conducteur ohmique} :
1.2.1. Donner l'expression littérale de en fonction des paramètres du circuit.
1.2.2. En déduire l'expression de l'inductance de la bobine et calculer sa valeur (elle doit être comprise entre 0,95 H et 1,20
H).
2. Modèle théorique
2.1. En utilisant la loi d'additivité des tensions et en respectant l'orientation du circuit, établir l'équation différentielle vérifiée
par l'intensité i(t).
2.2. Montrer qu’elle est du type :
dt
dx
+ .x = et vérifier que
Rr
L
et donner l'expression de .
2.3. Montrer que cette équation horaire peut s'écrire :
t
E
i(t) 1 e
Rr
. Montrer que cette solution valide bien l'équation
établie en 2.1.
3. Confrontation des résultats expérimentaux avec le modèle théorique. On rappelle que
x
xlim e 0
et
0
e
= 1
3.1. On appellera I l'intensité en régime permanent (l'intensité étant constante). Donner l'expression littérale de I. Calculer sa
valeur. Est-elle en accord avec la valeur expérimentale obtenue ?
3.2. Donner l'expression littérale de i(t) à la date t = en fonction de I. Calculer sa valeur. Est-elle en accord avec l'expérience ?
Exercice n°3 : La vitamine C
L'acide ascorbique (C6H8O6)aq ou vitamine C, que l’on trouve dans les oranges, par exemple, réagit partiellement avec l'eau selon
l'équation de la réaction : C6H8O6 (aq) + H2O (e) = C6H7O6- (aq) +H3O+
La constante d'équilibre est K = 8,9. 10-5 à 25 oC. On mesure, à l'aide d'un pH-mètre, le pH d’un jus d’orange : pH = 3,2.
1. Déterminer la concentration molaire en ions oxonium de cette solution.
2. Écrire l'expression littérale de la constante d'équilibre.
3. a. Établir le tableau d'avancement de la réaction pour l'état initial, un état intermédiaire et l’état final (équilibre).
b. Montrer que les concentrations [H3O+] et [C6H7O6] sont égales.
c. En déduire la concentration molaire de l’acide ascorbique dans le jus d’orange.
4. Quel est le taux d'avancement final du système chimique ?
Exercice n°4 : Ammoniac
On appelle constante de cellule k le rapport de la conductance G et de la conductivité de la solution σ.
On peut donc écrire la relation : G = σ k. Dans les conditions de l’expérience, la constante de cellule vaut k = 2,5 ×10-3 m.
Dans un bécher, on verse un volume V0 = 100 mL d’une solution S0 d'ammoniac de concentration apportée c0 = 5,0.10-3 mol. L -1.
On immerge la cellule d’un conductimètre. Celui-ci mesure une conductance de valeur G = 17,5 µS.
On note OH- la conductivité molaire ionique de l’ion hydroxyde HO- et
4
NH
la conductivité molaire ionique de l’ion
ammonium
4
NH
. A 25°C :
OH- =9 mS .m2. mo1-1 ;
4
NH
=7,34mS.m2.mol-l.
1. La conductance de la solution est-elle changée si on modifie l’un des paramètres suivants en gardant les autres identiques :
a. la concentration apportée c0 ; b. le volume V0 de la solution ; c. la température de la solution.
Pour chacun des paramètres, justifier la réponse.
2. Ecrire l’équation de la réaction modélisant la transformation entre l’ammoniac et l’eau.
3. Donner l’expression du quotient de réaction à l’équilibre Qr,éq associé à l’équation précédente et en déduire une relation entre
l’avancement final Qr,éq, xfinal, c0 et V0.
4. Donner l’expression de G, conductance de la solution et en déduire une relation entre G et l’avancement final xfinal.
Calculer la valeur de xfinal en mol.
5. Calculer le taux d’avancement final. La transformation peut-elle être considérée comme totale ?
6. Déterminer la valeur de la constante d'équilibre associée à cette réaction.
1
/
2
100%