05. Cours du 03/12/07

Mitose (deuxième partie) 3 décembre 2007
S. ROMANA
M1 Génétique – UE3
Ronéo : D.A. Khuong
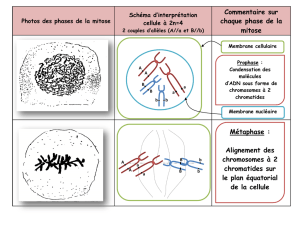
5 phases dans la mitose :
- antéphase et G2
- passage irréversible en mitose (mi-prophase)
- maintenir la cellule en métaphase
- sortie de mitose
- passage en interphase
Cycline CDK1 activation de CDK1 passage définitif en mitose
Rester en mitose
Cycline B-CDK1 activé : début de la mitose
- continuer la condensation des chromosomes
- activation d’APC (dégrade la cycline A)
- accrochage stochastique des microtubules aux kinétochores
- éviter la séparation prématurée des chromatides sœurs : le spindle check point
Microtubules et mitose
Il s’agit d’un réseau dense en interphase dans le cytoplasme, qui doit se desaggréger puis
se réorganiser.
Les fuseaux sont constituer de microtubules, dimères de tubulines alpha et beta qui
s’aggrègent pour former un microtubule et 13 protofilament forment un microtubule.
Il existe deux extrémités :
- proche du centrosome, le « minus end »
- l’autre extrémité, le « plus end ». La croissance se fait à cette extrémité, ainsi que
le rétrécissement rapide, qui est dynamique et instable.
Au niveau du plus end, la machinerie protéique est complexe car elle régule les
interactions intracellulaires et est impliquée dans le déplacement des différentes
organelles.
Polymérisation Alpha-beta GTP
Catastrophe Rescue
Dépolymérisation Alpha-beta GDP
Les organelles empruntent les voies des microtubules comme des rails. Par contre les
chromosomes sont fixés aux microtubules, pas de mobilité.
Les mouvements sont liés aux activités de microplymérisation et dépolymérisation.

Les MAP (microtubules associated proteins) se lient aux extrémités des microtubules :
- MT protéines destabilisantes
- MT plus end : stabilisation des microtubules.
Ex : APC stabilisent les microtubules, MCAK ont une action de déstabilisation.
Lors de la mitose, il y a réorganisation du cytosquelette microtubulaire.
A partir de la prophase : augmentation du turn-over des microtubules et diminution de la
polymérisation lors du NEB (disparition de la membrane nucléaire).
Les variations sont importantes entre l’interphase et la prophase.
Action des protéines qui stabilisent le réseau microtubulaire.
Intervention de facteurs non nucléaires dans la mise en place du fuseau mitotique.
Stabilisation des brins minus end par les gamma-tubulines.
Stabilisation des plus-end.
Les fibres interpolaires existent avant que la membrane nucléaire soit dissoute.
Phosphorylation par CDK1 de MAP 1125 qui entraînent des catastrophes de fibres
interphasiques et tubulines disponibles pour le fuseau.
Le kinétochores stabilisent l’extrémité plus du microtubule.
La congression chromosomique permet
- d’amener le chromosome à une situation équidistante aux deux pôles de la cellule
(polymérisation d’un microtubule et dépolymérisation de l’autre microtubule),
- la fixation du microtubule au kinétochore,
- la ségrégation à l’anaphase.
Le spindle check point permet
- de rester en métaphase,
- de ne pas passer en anaphase,
- l’absence de décondensation des chromosomes,
- l’absence de reformation de la membrane nucléaire.
Les chromosomes sont dupliqués au niveau du centromère, la fibre chromosomique est
au niveau du kinétochore (qui correspond à plusieurs microtubules condensés).
Le kinétochore est une structure protéique accolés au centrosome, avec trois couches : les
microtubules sont fixés à la couche externe, la couche interne est en contact avec la
chromatine.

Schéma du centromère
Il n’existe pas de structure primaire spécifique au centromère, avec existence d’un néo-
centromère. Séquences répétées satellites alphoïdes.
Couche interne : protéine centromérique A liée aux séquences alphoïdes.
Couche externe : complexe protéique permettant le check-point mitotique et la protection
des centromères.
Protéines du spindle check point : MAD 1, MAD 2, BUB 1, BUB 3, BUB R1, MSP 1,
Kinésine CENP-E
Couche externe du kinétochore
MAP K CENP-E
MSP 1
BUB3 BUBR1
MAD1 MAD2
ROD ZW10
BUB1

CENP-E phosphoryle BUBR1, puis BUBR1 active MAD2 par phosphorylation. CDC20
se lie alors à MAD2 : le spindle check point est actif.
Puis dynéines et dynactines se fixent aux plus-end par ZW10 (protéine constitutive du
kinétochore)
Puis fixation du microtubule sur GENP-E et CDC 20 qui entraine un changement
conformationnel et la desactivation de BUB R1.
CDC 20 va alors quitter le kinetochore et activer APC le spindle check point est
inactivé.
CDC 20-APC va dégrader la cycline B.
CDH 1-APC va dégrader la sécurine.
tous les phénomènes liés à l’activité de CDK 1 cessent, avec destruction de la
membrane nucléaire par desphosphorylation des lamines.
APC va dégrader la sécurine : entrée en anaphase. La séparase va pouvoir agir.
Les kinases
Cyclines dépendantes kinases : CDK 1
Cycline A : fin phase S, G2-M, début prophase
Détruite par APC-CDC 20
Cycline B : cycline de la mitose
Activation par phosphatase CDC 25
Reste active jusqu’au début de l’anaphase
Polo-like kinase : PLK 1-3 activent CD25 et cycline B
Le Spindle check point : BUB R1, activation d’APC, déstabilisation des cohésines.
Aurora kinase B : gardien de la formation du fuseau bien orienté.
Aurora kinase A : gardien du bon fonctionnement du centrosome.
Anomalies de la mitose
Orientation amphitélique des kinétochores : vers deux poles opposés.
Orientation monotélique : un seul kinétochore est connecté.
Orientation syntélique : les deux kinétochores sont orientés vers le même pôle.
Orientation mérotélique : un des kinétochores est orienté vers les deux pôles en même
temps.
Ces anomalies entrainent des anomalies de nombres.
Cancer et cycle mitotique
Mutations constitutionnelles dans BUB 1B (BUB R1)
Prédisposition aux cancers (lymphomes et leucémies)
Anomalies de la duplication des centrosomes.

Quel est le rapport entre l’organisation des chromosomes sur la plaque mitotique et leur
topographie en interphase ?
Les chromosomes occupent des territoires définis en interphase mais est-ce au hasard ou
non ?
(peinture chromosomique : observation différente en fonction des espèces, en fonction
des cellules)
Rapport métaphase-interphase
(Cell, vol 112, 751-764, March 21, 2003)
Hétérochromatine constitutive et ségrégation chromosomique en anaphase.
Anaphase promoting complex : proteolysis and mitosis : Jan MICKAEL, Molecular cell,
vol 9, 931-943, mai 2002
Les ubiquitin ligase sont des complexes protéiques de haut poids moléculaire.
L’ubiquitinylation dépend de E1 :
- ubiquitin activating
- ubiquitin conjugating
- protéine activant APC comme CDC 20
APC est constitué de 11 sous-unités. Elle active la séparase et initie l’anaphase.
Sinon blocage de la mitose avant séparation des chromosomes.
La destruction de la sécurine entraine une libération de la séparase puis une activation par
déphosphorylation.
APC-CDC 20 protéolyse la cycline B.
Rôle dans la métaphase : alignement des chromosomes grâce à XKID.
Fonction anti-inhibiteur de l’anaphase.
APC-CDC 20 et APC-cdh1
APC-cdh1 : empêche l’accumulation des cyclines (destruction)
l’activation de la phase S (CDK inactifs)
régule aussi le signal TGF beta
- activation de la transcription d’inhibiteurs CDKp15 et p21
- inhibition de l’expression du facteur de transcription MYC.
La biblio pour la prochaine séance
Activating and silencing the mitotic check point through CEMP-E dependent
activation/inactivation of BUB R1
MAO, Y, Cell, vol 114, 87-98, 2003
1
/
5
100%