Word PC - Société Française de Physique

CLASSE DE SECONDE :
PROPOSITION DE PROGRESSION EN CHIMIE
La matière dans l’Univers ou l’univers de la matière.
Le programme de Chimie, comme celui de Physique, comporte un Tronc commun et une Partie
complémentaire.
La partie Tronc commun comprend :
1. Matière chimique ou naturelle ? (8 heures de cours, 4 séances TP)
1.1 Mise en évidence de l’ubiquité des espèces chimiques ; la chimie est partout !
- la chimie du monde
- le monde de la chimie
1.2. Approches expérimentale et historique de l’extraction et de l’identification des espèces
chimiques
- extractions d’espèces chimiques
a) techniques d’extraction
b) les techniques d’extraction dans l’histoire
- techniques d’identification
a) chromatographie
b) caractéristiques physiques
1.3. Synthèse d’une espèce chimique
- mise en évidence de la nécessité de la chimie de synthèse
- caractérisation d’une espèce synthétique et comparaison avec une espèce extraite de la nature
2. Constitution de la matière (8 heures de cours, 4 séances TP)
2.1. Des modèles simples de description de l’atome
- un modèle de l’atome
- l’élément chimique
- un modèle du cortège électronique
2.2. De l’atome aux édifices chimiques
- les règles du duet et de l’octet
- enoncé des règles
- ions monoatomiques stables
- modèle de Lewis
- la géométrie de quelques molécules simples
2.3. La classification périodique des éléments
2.4. La diversité de l’organisation de la matière
3. Transformations de la matière (8 heures de cours, 4 séances TP)
3.1. Outils de description d’un système chimique
- de l’échelle microscopique à l’échelle macroscopique : la mole
- concentration molaire en solution
3.2. Transformation d’un système chimique

- réaction chimique modélisant la transformation d’un système chimique
- avancement de la transformation et bilan de matière
La Partie complémentaire est constituée de :
1. Thèmes physique et chimie (12 heures de cours, 6 séances TP), comme :
- principe et utilisation d’un spectrophotomètre
- grandeurs physiques proportionnelles ou non à la quantité de matière : courbe d’étalonnage et
applications aux dosages
- chimie, physique et art….
2. Thèmes chimie (6 heures de cours, 3 séances TP)
- le sucre : extraction, dosage par réfractométrie, aspects historique et industriel, dosage par liqueur de
Fehling….
- des “ produits ” de la vie courante : analyse et dosage de boissons, désinfectants, médicament,
produit antimousse
- chimie et engrais….
- synthèse de “ produits ” d’usage courant dans les domaines de la santé, de l’alimentation….

TRONC COMMUN
1. Matière chimique ou naturelle ?
(8 heures de cours, 4 séances TP)
Objectifs :
Grâce à des séances pratiques attrayantes, cette première partie a pour but de donner le goût de la
chimie et de faire prendre conscience de son importance croissante pour la société au cours de
l’histoire. L’ancrage sur des espèces chimiques naturelles a pour objectif de démystifier la chimie et de
susciter une réflexion sur l’opposition médiatique entre chimie et nature. De nombreuses espèces
chimiques présentes dans la nature sont importantes pour l’homme qui, au cours de son histoire, a
cherché à les extraire. Les impératifs économiques ont amené l’homme à copier la nature ou à trouver
des espèces de substitution. C’est la raison d’être des approches expérimentale et historique de
l’extraction et de la nécessité de la synthèse.
Au cours de cette partie, il s’agit de réinvestir les acquis du collège sans redondance. Les
espèces et les transformations chimiques rencontrées dans cette partie seront reprises comme exemples
pour illustrer les parties suivantes. Les savoir faire expérimentaux et les comportements mis en place
dans cette partie constituent le fondement d’un bon déroulement des activités ultérieures de la classe
de seconde et sont transférables dans d’autres disciplines, mais aussi dans la vie quotidienne.
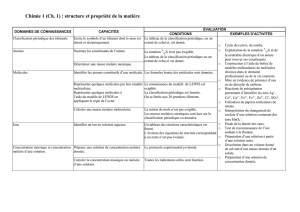
1.1 Mise en évidence de l’ubiquité des espèces chimiques ; la chimie est partout !
Exemples d’activités
Contenus
Connaissances et savoir faire exigibles
“ les 5 sens du chimiste en
éveil ” :
- observation d’un “ produit ” de
la nature (un fruit…) ou d’un
“ produit ” manufacturé
(papier..).
- mise en évidence de la richesse
chimique d’un objet de notre
quotidien (activité guidée par un
questionnement) et inventaire
sommaire des espèces chimiques
qu’il contient.
- à partir d’activités de notre
quotidien, de notre
environnement ou de domaines
d’importance économique
incontournable, mise en
évidence et classement des
espèces chimiques.
- traduire en termes chimiques
l’approche sensitive d’un objet
- la chimie du monde
- le monde de la chimie
réinvestir et faire la synthèse de
connaissances acquises dans des
contextes variés : environnement
quotidien, informations par les média,
connaissances antérieures de sciences
physiques (collège), de SVT …
- savoir que certaines espèces chimiques
proviennent de la nature et d’autres de la
chimie de synthèse.
- savoir classer des espèces chimiques en
espèces organiques et en espèces
inorganiques.
- savoir mener une recherche
documentaire en vue de situer des
ordres de grandeur de quelques
productions de l’industrie chimique.

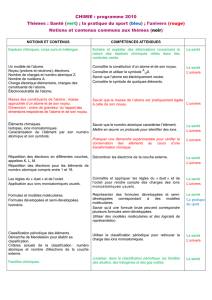
1.2 Approches expérimentale et historique de l’extraction et de l’identification des espèces
chimiques.
Exemples d’activités
Contenus
Savoir-faire exigibles
A partir d’une espèce naturelle
:
- réaliser une décoction,
- présenter ou réalise une
hydrodistillation,
- réaliser une décantation,
- présenter ou réaliser une
filtration sous vide.
Elaboration d’un protocole
d’extraction à partir
d’informations sur les
propriétés physiques et
chimiques recherchées.
Documentation (textes,
iconographie, transparents,
vidéo...)
Extractions d’espèces
chimiques.
a) Techniques d’extraction.
Comparaison expérimentale
du pouvoir de dissolution de
deux solvants vis-à-vis d’une
espèce chimique donnée.
b) Techniques d’extraction
dans l’histoire.
Techniques d’identification.
Caractérisation ou identifiation
par comparaison d’une espèce
chimique organique ou
minérale extraite.
a) chromatographie.
principe : phase fixe, phase
mobile, révélation,
interprétation, application en
analyse.
b) caractéristiques physiques
Tf, Teb, densité, indice de
réfraction (vu en physique),
couleur, solubitiés dans l’eau
(milieu acide ou basique) et
dans différents solvants
organiques.
Savoir s’informer sur les risques et
les consignes de sécurité à respecter
lors de la manipulation de solvants
organiques.
Savoir utiliser un appareil de
chauffage dans des conditions de
sécurité.
Savoir utiliser une ampoukle à
décanter.
Savoir utiliser un dispositif de
filtration.
A partir d’un tableau de données
(température de changement d’état,
solubilités, masses volumiques) :
- reconnaitre l’état physique d’une
espèce chimique à une température
donnée,
- faire l’inventaire des espèces
chimiques présentes dans un
système,
- identifier les espèces chimiques
dans un système constitué de deux
liquides non miscibles.
Connaître quelques exemples de
techniques utilisées dans l’histoire
pour l’extraction d’espèces
chimiques.
Savoir réaliser une chromatographie
sur couche mince.
Savoir interpréter les informations
de l’étiquette d’un flacon (risques,
sécurité, paramètres physiques)
comme une carte d’identitié de son
contenu.
Réinvestir les acquis du collège sur
les caractéristiques physiques :
savoir proposer des méthodes pour
déterminer une masse volumique,
une température d’ébullition ou de
fusion.
1.3. Synthèse d’une espèce chimique

Exemples d’activités
Contenus
Connaissances et savoir-faire
exigibles
Synthèse (ou hémisynthèse)
d’une ou plusieurs espèces
chimiques, mettant en jeu des
techniques simples (chauffage à
reflux, filtration, séparation...)
si possible choisir de synthétiser
une des espèces extraites en 1.1.
Réinvestir les acquis
expérimentaux de la partie 1.2.
pour vérifier qu’une espèce
chimique de synthèse est
identique à la même espèce
chimique extraite de la nature.
Mise en évidence de la
nécessité de la chimie de
synthèse.
Décrire quelques exemples de
synthèse dans la chimie lourde et
dans la chimie fine (à haute
valeur ajoutée) au choix parmi :
élaboration d’un métal, synthèse
d’une fibre, d’un polymère,
d’un engrais, d’un médicament,
d’un arôme, d’un colorant...
Justifier la nécessité des
synthèses choisies à partir des
matières premières de la nature
et des besoins des
consommateurs.
Caractérisation d’une espèce
chimique synthétique et
comparaison avec une espèce
extraite de la nature.
Suivre un protocole en
respectant les consignes
(sécurité, environnement).
Comprendre l’intérêt de la
synthèse chimique pour la
société.
Elaborer une méthode
expérimentale pour résoudre le
problème posé.
Savoir interpréter, discuter et
présenter les résultats d’une
analyse comparative.
.
Commentaires :
On illustre, autant que faire se peut, les synthèses choisies par des expériences de cours.
On adopte une écriture simplifiée des réactions chimiques pour les transformations décrites, en se
limitant aux appellations ou aux formules brutes des espèces chimiques, indiquées sur les flacons. On
ne fait pas appel à une écriture plus détaillée qui sera abordée plus tard dans le programme (3.2
Transformation d’un système chimique).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%