Chapitre 21

MPSI Chapitre
21
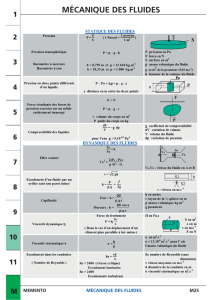
PRESSION ET TEMPÉRATURE
21-1 Introduction à la thermodynamique
21-1-1 But de la thermodynamique
Les lois physiques élémentaires qui régissent les interactions entre les diverses particules permettent
théoriquement de déterminer le comportement d'un échantillon de matière. Mais le nombre de variables
microscopiques à déterminer est énorme.
Par exemple, pour un gaz monoatomique, comme l'hélium, 4 mg de matière contiennent environ
6.1020 molécules, dont la description nécessiterait, en considérant ces molécules comme ponctuelles, la
connaissance de 18.1020 coordonnées de position et 18.1020 coordonnées des vitesses. Bien entendu
l'ensemble de ces variables est inaccessible.
La thermodynamique permet l'étude du comportement global d'un échantillon de matière. Celui-ci
sera caractérisé par un ensemble de grandeurs extensives telles que son volume, les quantités de matière de
ses constituants, son énergie interne... et de grandeurs intensives telles que sa température, sa pression, sa
masse volumique...
Les grandeurs extensives caractérisent l'ensemble du système alors que les grandeurs intensives ne
sont que des moyennes locales.
Par exemple, la masse volumique de l'ensemble du système ne donne aucun renseignement sur la
masse volumique d'une partie du système. La masse volumique en un point précis du système n'a aucune
signification du fait de la structure discontinue de la matière et de l'impossibilité de localiser exactement une
particule élémentaire ou de lui attribuer un volume précis... La grandeur masse volumique que l'on considère
habituellement est donc supposée être calculée à un échelle, intermédiaire entre l'échelle macroscopique et
l'échelle microscopique (atomique), que l'on nomme l'échelle mésoscopique :
d
dm
avec d de l'ordre de
106 nm3 (soit 10–21 m3) par exemple. Ce volume "élémentaire" est donc très petit devant les volumes à
l'échelle macroscopique et très grand devant celui d'une molécule, il englobe des millions ou des milliards de
molécules.
Le lien entre les propriétés macroscopiques décrites par la thermodynamique et les propriétés
microscopiques est le domaine de la mécanique statistique.
21-1-2 Structure de la matière, notion de modèle
L'interprétation des propriétés macroscopiques amène à proposer des modèles pour la structure et les
propriétés microscopiques de la matière. Le modèle imaginé permet alors la prévision d'autres propriétés
macroscopiques qui seront ou non confirmées par l'expérience. Tout écart entre les propriétés réelles et celles
qu'implique le modèle amène, à retoucher celui-ci. Les connaissances sur la structure de la matière ont ainsi
été obtenues le plus souvent par approximations successives, leur vérification directe par des moyens
permettant d'accéder directement à la mesure de grandeurs microscopiques n'est le plus souvent intervenue
que postérieurement.
21-2 Pression en un point d'un fluide
21-2-1 Définition de la pression
Un fluide en équilibre mécanique, c'est-à-dire dans lequel aucun mouvement d'ensemble ne se
superpose au mouvement microscopique d'agitation thermique, exerce une force pressante normale à la
surface pressée sur tout élément de surface en contact avec lui (surface du récipient, mais aussi surface au
sein même du fluide).
Il en est de même pour un fluide en mouvement, à condition que sa viscosité soit nulle. On parle alors
de fluide parfait. tout élément du fluide peut glisser sur les autres sans frottement donc sans leur transférer
de quantité de mouvement. Il s'agit là bien sûr d'un modèle idéal dont les fluides réels ne peuvent que
s'approcher plus (gaz) ou moins (glycérol).

On montre à l'aide d'une capsule manométrique que l'intensité de la force pressante ne dépend pas
de l'orientation de la surface pressée. Pour une surface de petite dimensions, elle est proportionnelle à
l'aire de la surface pressée.
La force pressante élémentaire
P
Fd
exercée sur un élément de surface dS, caractérisé, par un vecteur
Sd
normal à cette surface, orienté du fluide qui exerce la force vers le solide ou vers le fluide qui la subit est
donc de la forme
SdpFd P
pour tout fluide parfait et pour tout fluide en équilibre mécanique. p est la
pression du fluide sur la surface dS.
(Pour un fluide visqueux, en mouvement,
SdpFd P
n'est que la composante normale de la force
exercée par le fluide sur dS).
L'unité S.I. de pression est le pascal 1 Pa = 1 N.m–2 = 1 kg.m–1.s–2 .
- La pression standard utilisée en chimie est 1 bar = 100 kPa
- La pression normale est de une atmosphère : 1 atm = 101,325 kPa
21-2-2 Gradient d'un champ scalaire
Soit une grandeur physique scalaire A (c'est-à-dire produit d'un réel par une unité de mesure) liée à
chaque point M d'une région de l'espace physique et dépendant éventuellement du temps. A est donc fonction
des coordonnées cartésiennes x, y, z de M et de t : A = f(x,y,z,t). A est alors un champ scalaire.
La pression, la température, la masse volumique, la densité volumique de charge électrique... sont des
champs scalaires.
Par définition, le gradient de A est le champ vectoriel
zyx u
z
A
u
y
A
u
x
A
Agrad
.
La différentielle de A s'écrit
dt
t
A
dz
z
A
dy
y
A
dx
x
A
dA
.
On a donc :
dt
t
A
MdAgraddA .
: Définition intrinsèque du gradient.
Pour un champ scalaire uniforme :
M0Agrad
et dA =
dt
dt
dA
.
Pour un champ scalaire stationnaire :
0
t
A
et
MdAgraddA .
, (de même si t est fixé).
On admettra que si A est continu et borné sur le volume V limité par la surface on peut appliquer le
deuxième théorème du gradient :
VdAgradSdA
.
21-2-3 Une condition locale d'équilibre mécanique du fluide
Soit un élément de fluide de volume V soumis au champ de pression p = f(M,t). La surface limitant V
étant , la somme des forces pressantes exercées sur l'élément de fluide est :
SdpFP
.
(
Sd
est orienté vers l'extérieur de pour le calcul de l'intégrale, alors que les forces pressantes sont orientées
vers l'intérieur, d'où le signe –).
L'application du deuxième théorème du gradient donne :
V
PdpgradF
.
L'élément de fluide considéré est soumis à ces seules forces de contact s'il est en équilibre ou si le
fluide a une viscosité nulle.
Il est aussi soumis à des forces à distance, forces de pesanteur, éventuellement forces électriques,
forces d'inertie.... Soit
f
le champ de densité volumique des forces à distance. Ceci signifie qu'un volume

élémentaire d est soumis à la force à distance
dfFd
en plus des forces pressantes.
L'élément de fluide considéré subit donc la force totale :
dpgradfFF V
P
.
La condition d'équilibre du fluide est donc
dpgradfFF V
P
=
0
,
V
.
D'où la condition d'équilibre locale :
pgradf
.
21-2-4 Loi fondamentale de la statique des fluides
Pour un fluide de masse volumique , soumis, en plus des forces pressantes, aux seules forces de
pesanteur, dans le champ de pesanteur
g
, la force de pesanteur agissant sur un élément de volume d est
dgFd
.
La densité volumique des forces de pesanteur est le poids volumique
gf
.
Si le fluide est en équilibre :
gpgrad
.
Si l'on considère
g
comme pratiquement vertical et le système assez peu étendu en latitude et en
longitude, on a
z
ugg
avec g fonction de z seul et z'z étant un axe vertical ascendant, (axe des altitudes),
on a
zz ugu
dz
dp
pgrad
soit : loi fondamentale de la statique des fluides :
g
dz
dp
.
Si le fluide est incompressible et homogène, sa masse volumique ne dépend pas de la pression et elle
est uniforme. Si de plus g est uniforme la loi fondamentale de la statique des fluides peut alors s'intégrer
simplement, en notant p0 la pression à l'origine choisie pour les altitudes :
gzpp 0
.
Pour un gaz sous une pression de l'ordre de 105 Pa, dans un récipient de hauteur limitée, par exemple
1 m, la masse volumique étant de l'ordre du kg.m–3, la différence de pression entre le haut et le bas du
récipient est de l'ordre de 10 Pa, elle est négligeable devant 105 Pa. On pourra donc le plus souvent
considérer que la pression dans un gaz en équilibre contenu dans un récipient de hauteur limitée est
pratiquement uniforme.
21-2-5 Application à la mesure des pressions
Les pressions sont mesurées avec des manomètres. Ceux-ci utilisent soit les déformations d'objets
métalliques sous l'effet de la pression soit l'effet piezoélectrique. Des mesures précises peuvent encore être
effectuées en mesurant une dénivellation dans un tube contenant du mercure. Les avantages du mercure sont
sa masse volumique élevée et sa pression de vapeur saturante très faible.
Dans un manomètre barométrique, le vide règne au dessus de la colonne de mercure (ou plus
exactement, de la vapeur de mercure à sa pression de vapeur saturante), le gaz dont on veut mesurer la
h
p
vide
h
p
vide

pression est en contact avec le mercure à une hauteur h en dessous . on a donc
ghp
.
On appelle mercure normal le mercure à 0 °C, sous la pression normale, en un lieu où g = 9,80665
m.s–2 sa masse volumique est alors = 13595 kg.m–3. La pression normale correspond à une dénivellation de
760 mm de mercure normal. 101325 Pa = 0.76000 m
9.80665 m.s–2
13595 kg.m-–3
La pression correspondant à une dénivellation de 1 mm de mercure normal est encore appelée 1 torr.
1 torr = 133,32 Pa.
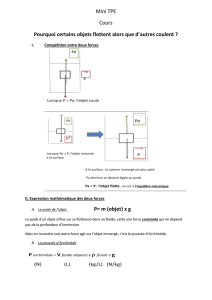
21-2-6 Poussée d'Archimède
Si un objet de surface est immergé dans un fluide en équilibre dans un référentiel galiléen, les
forces pressantes qu'il subit ont pour résultante une force nommée poussée d'Archimède :
Sdp
.
Cette force est la même que celle que subirait le fluide en équilibre qui occuperait la place de l'objet
("fluide déplacé"). Le fluide étant en équilibre, la poussée d'Archimède est donc l'opposé du poids du fluide
déplacé.
Soit V le volume délimité par et ' la masse volumique du liquide. La poussée d'Archimède est
donc
dg'
V
.
Soit C le centre d'inertie du fluide déplacé; le point d'application du poids du liquide déplacé est donc
C. Le théorème du moment cinétique appliqué en C au fluide déplacé donne :
0
dt
Ld
CC C
C
donc le moment en C de la poussée d'Archimède est nul. Tout se passe donc comme si la poussée
d'Archimède était une force unique appliquée en C. Ce point est appelé centre de poussée.
D'où le Théorème d'Archimède :
Un corps plongé dans un fluide en équilibre subit de la part de ce fluide des forces pressante dont
la résultante est l'opposé du poids du fluide qui occuperait la place de ce corps.
Le point d'application de la poussée d'Archimède est le centre de poussée, c'est le centre d'inertie
du fluide qui occuperait la place du corps considéré.
Si le champ de pesanteur peut être considéré comme uniforme, le poids du corps, supposé homogène,
de masse volumique est
gV
. La poussée d'Archimède est – ' V
g
.
Si de plus le fluide est homogène, le centre de poussée coïncide avec le centre d'inertie du corps, c'est
son centre géométrique.
21-3 Échelles thermométriques
21-3-1 Équilibre thermique, principe zéro de la thermodynamique
Si l'on plonge un fil métallique dans de l'eau chaude contenue dans une enceinte adiabatique, (c'est-à-
dire empêchant les échanges d'énergie sous forme de chaleur avec l'extérieur), il s'allonge et sa résistivité
électrique croît. Lorsque ces grandeurs ont cessé de varier, on dit qu'il y a équilibre thermique entre l'eau
chaude et le fil. On dira encore qu'ils sont à la même température.
Le Principe zéro de la thermodynamique s'énonce ainsi :
Deux systèmes en équilibre thermique avec un même troisième sont en équilibre thermique entre eux.
Si le calorimètre précédent comporte deux compartiments A et B, les liquides de ces deux
compartiments étant en équilibre thermique, et 1e fil précédent étant en équilibre thermique avec le liquide
de A, si on le transfère de A à B instantanément, il sera en équilibre thermique avec le liquide de B, sa
longueur ne variera pas, sa résistance électrique non plus.
21-3-2 thermomètres, échelles de température
On définit la relation d'ordre dans l'ensemble des températures de la façon suivante :
La température d'un système A est supérieure à celle du système B si lorsqu'on les met en contact
l'échange de chaleur se fait dans le sens de A vers B. La chaleur reçue par B de la part de A est positive :

0QBBA
Tout objet dont une grandeur caractéristique est une fonction monotone de la température est un
thermomètre. La grandeur considérée est une grandeur thermométrique.
Toute fonction monotone de cette grandeur constitue une échelle thermométrique. La relation entre
la grandeur considérée et la température dans cette échelle est une équation thermométrique.
Exemple : Une règle de cuivre, tant qu'on ne la soumet à aucune contrainte mécanique, est un
thermomètre; sa longueur L est une fonction croissante de la température. Il est simple de choisir comme
équation thermométrique une fonction affine, L = A + B, (ou = a L + b) mais à priori, une fonction plus
complexe convient aussi du moment qu'elle est monotone.
21-3-3 Échelles centésimales de température
Si l'on choisit A et B tels que = 0 ° quand la règle est en équilibre thermique avec de la glace
fondante sous la pression normale et = 100 ° quand elle est en équilibre thermique avec de l'eau en
ébullition sous 1a pression normale, on a alors une échelle centésimale de température.
On pourra noter ces températures particulières 0 °C et 100°C (degrés Celcius) car l'échelle Celcius est
une échelle centésimale.
Toutes les échelles centésimales ne coïncident pas, elles ne coïncident à priori que pour 0 °C et pour
100 °C. Il faut donc trouver une échelle qui ne dépende pas des propriétés particulières de tel ou tel corps.
La température telle qu'elle est donnée par une échelle centésimale définie ci-dessus ne constitue pas
une "grandeur mesurable". Une grandeur est "mesurable" seulement si l'on peut définir l'égalité de deux de
ses valeurs, (ce qui est déjà fait pour la température), et si on peut définir le rapport de deux de ses valeurs. Il
est évident que le rapport de deux température n'est pas défini par une échelle centésimale puisqu'il dépend
de l'instrument de mesure choisi et de l'équation thermométrique qu'on lui a associée.
21-4 Température absolue, échelle légale de température
21-4-1 Propriétés thermoélastiques des gaz aux faibles pressions.
Pour une masse déterminée d'un gaz donné, dont on repère la température sur une échelle centésimale
quelconque, on peut constater qu'à l'équilibre, si deux paramètres, parmi p, V et , sont fixés le troisième est
aussi fixé, il existe donc une relation entre ces trois paramètres qui traduit les propriétés thermoélastiques du
gaz, on la nomme équation d'état ou équation caractéristique du gaz. On peut la mettre sous la forme :
Équation d'état f (p,V,) = 0.
La courbe représentant P en fonction du volume molaire Vm
n
V
pour une température déterminée
est une isotherme en coordonnées de Clapeyron. Elle a l'allure d'une hyperbole si la température n'est pas
trop basse
Il est donc intéressant de représenter cette isotherme en coordonnées d'Amagat : pVm en fonction de
p. On constate que le produit pVm n'est pas constant à température constante. Mais l'écart reste faible,
par exemple, pour CO2, à 0 °C, pVm diminue de 1,7 %. quand la pression passe de 1 à 3 bars. De plus la
pente dépend de la température.
p
Vm
θ1
θ2
θ3θ1 < θ2< θ3
p
Vm
θ1
θ2
θ3θ1 < θ2< θ3
Vm
θ1
θ2
θ3θ1 < θ2< θ3
 6
6
 7
7
1
/
7
100%