Chimie 30S Unité : Les Gaz et l`Atmosphère : Travail Leçon 1 à 3

Chimie 30S
Unité : Les Gaz et l’Atmosphère : Travail Leçon 1 à 3
Nom : _____________________ /46 Date : ________________________
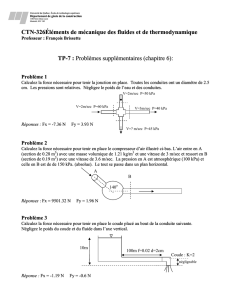
/4 1. a) Les pneus de votre voiture doit avoir 32,0 psi, quelle serait (en kPa) la pression de vos pneus (2)
b) Si vos pneus ont une pression de 250 kPa, quelle serait la pression en psi ? (2)
/2 2. Détermine la plus petite température en Kelvin et en Celsius qui sont possible. Qu’est-ce que c’est
le nom de ces températures ?
/2 3. La pression partielle de l’argon, qui constitue 40 % d’un mélange, est de 325 torrs. Quelle est la
pression totale du mélange en kilopascals ?
/2 4. La pression d’un mélange d’azote et de bioxyde de carbone est de 1,00 atm, et sa température est
de 278 K. Si 30% du mélange est de l’azote, quelle est la pression partielle du bioxyde de carbone ?
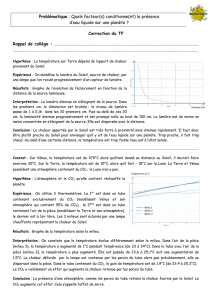
/3 5. On enferme 0,750 L d’oxygène à 101,3 kPa dans un cylindre muni d’un piston mobile. On déplace
le piston, et le gaz est comprimé à un volume de 0,500 L. Quelle est la pression finale appliquée à
l’oxygène gazeux si la température demeure constante ? Identifie le scientifique qui a établi cette loi.

Chimie 30S
Unité : Les Gaz et l’Atmosphère : Travail Leçon 1 à 3
/3 6. L’ammoniac gazeux, NH3(g) est utilisé dans la production des engrais. On trouve qu’un
échantillon d’ammoniac gazeux à 55,0oC exerce une pression de 7,5 atm. Quelle pression le gaz
exercera-t-il si son volume est réduit à un cinquième de son volume initial à 55,0oC ?
/4 7. Un échantillon de 25 g d’air sec dans un gros ballon de fête à 20oC occupe un volume de 20 L. si
la température est augmentée à 40oC à pression constante, quel sera le volume occupé par le volume.
Identifie le scientifique qui a établi cette loi.
/3 8. Un ballon d’anniversaire contient 2,0 L d’air à TPN. Quel sera son volume à température
ambiante et pression normale ? Identifie cette loi.
/3 9. L’argon gazeux est utilisé à l’intérieure des ampoules électriques parce que c’est un gaz très
inerte. On chauffe 650 cm3 d’argon gazeux à TPN afin de doubler son volume à 101,3 kPa. Quelle est
la température finale (en degré Celsius) ? Qu’est-ce que inerte signifie ?

Chimie 30S
Unité : Les Gaz et l’Atmosphère : Travail Leçon 1 à 3
/3 10. Le méthane, un gaz naturel, est entreposé dans un réservoir de 100 L à -10oC et à une pression de
125 atm. Le gaz est utilisé comme combustible pour chauffer une maison de campagne durant l’hiver.
L’appareil de chauffage central consomme en moyenne 500 L de méthane par jour. Pendant combien
de temps cette réserve de méthane durera-t-elle si le méthane est brûlé à 450oC, à une pression de 102
kPa.
/3 11. Le néon est abondamment utilisé comme gaz luminescent dans les annonces lumineuses. Un
échantillon de néon a un volume de 5,5 L à 750 torrs et à 10,0oC. Si le gaz est dilaté à un volume de 7,5
L à une pression de 400 torrs, quelle sera sa température finale (en degré Celsius) ?
/2 12. Au cours d’une visite chez ton médecin, celui-ci prend la tension artérielle. La lecture est de
125,0 mm de Hg pour la systolique est de 80,0 mm de Hg pour la diastolique. Quelle est la tension
artérielle en kilopascals ?
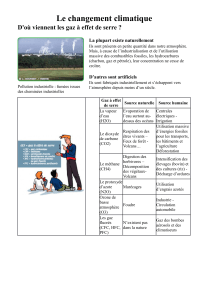
/2 13. Détermine la pression que Eric exerce s’il est assis sur une chaise. Il pèse 54 kg et la force qu’il
exerce sur la chaise est 500 N. La surface du siège est de 0,15 m2.

Chimie 30S
Unité : Les Gaz et l’Atmosphère : Travail Leçon 1 à 3
/10 14. a) Indique les types de gaz qui se trouve dans l’atmosphère ainsi que leurs abondances. (4)
b) Choisit les trois gaz le plus abondant dans l’atmosphère et explique leur importance. (6)
1
/
4
100%