DERIVES DES CRETES NEURALES

DERIVES DES CRETES NEURALES
Plan :
I. Anatomie embryonnaire
A. Espace
B. Temps
II. Lignées cellulaires
III. Devenir des cellules des crêtes neurales (NCC)
A. Déterminants spatiaux
B. Déterminants moléculaires
Introduction
Les dérivés des crêtes neurales peuvent être très variés, donc les pathologies associées
peuvent aussi être très variées.
Les neurocristopathies sont les conséquences cliniques de problèmes dans la prolifération/
mort cellulaire, migration et la differenciation des NCC.
Exemples : maladie de Hirschsprung (1/5000), malformation de la fente palatine
(1/1000), malformations cardiaques (CCN sont indispensables pour la formation du cœur,
1/500), neuroblastome ( 10 % des cancers pédiatriques), mélanome....
I. Anatomie embryonnaire
Quatre dimensions vont déterminer la destinée des crêtes neurales.
Les cellules des crêtes neurales (CCN) se différencient tout le long du système nerveux
central, sur l’axe antéro-postérieur et surviennent à tous les niveaux du corps.
Elles vont migrer avec un différentiel temporel : ainsi les premières cellules vont commencer
à s’éloigner de ce tube neural au niveau de la tête et ce n’est qu’à la fin de la première
semaine qu’elles vont le faire au niveau caudal.
Ce mécanisme est très important pour comprendre les malformations segmentaires.
Les cellules une fois leur migration effectuée vont passer du côté dorsal vers le ventral.
CCN vont infiltrer quasiment tous les organes du corps.
-Vie prénatale :
Les deux facteurs du développement embryonnaire (2 premiers mois) sont le temps et
l’espace.
On parle de vie fœtale (passé les deux premiers mois) du 3ième au 9ième mois.
On va observer la croissance des organes ce qui correspond à l’augmentation de la taille des
organes et à la maturation de ces mêmes organes (par ex : le rein, le cerveau,…)
Le déroulement de la différenciation des organes est plus linéaire.
Beaucoup d’organes ont une maturation assez tardive et même au delà de la naissance.
Il existe une continuité entre vie fœtale et périnatale en fonction du système d’organes
concerné.
On peut faire appel à des modèles animaux, car la croissance est assez semblable au moins
chez les vertébrés. Les vertébrés partagent donc un même plan de développement primitif.

Ainsi les membres, les segments de corps ou le cerveau se retrouvent dans des positions
similaires chez l’homme, le poulet et la souris…
Cependant les temps de gestation sont très différents.
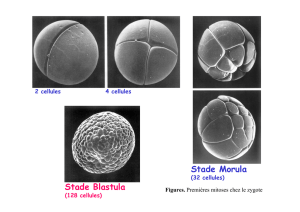
Au début, tous les amniotes ont 3 feuillets embryonnaires :
- Ectoderme (extérieur de l’embryon)
- Mésoderme
- Endoderme
Plusieurs changements morphologiques se font en même temps sous la direction de gènes.
La partie de l’ectoderme qui va se différencier au dessus du notochorde sera la plaque neurale.
En même temps, le mésoderme va s’organiser et se mettre à faire des petites boules de part et
d’autre du notochorde, c’est-à-dire les somites.
En dessous, on aura la formation des premiers vaisseaux à proximité de l’endoderme.
La plaque neurale va se plier sur elle-même et les bourrelets vont s’élever pour se rencontrer
sur la face dorsale du futur organisme.
L’ectoderme continue à proliférer, contrôlé par les mêmes gènes qui contrôlent la
prolifération tumorale.
En dessous et au dessus, on a des membranes extra embryonnaires, toujours l’endoderme, le
mésoderme et l’ectoderme mais ils ne vont pas faire partie de l’organisme après la naissance.
Les bourrelets vont fusionner sur le côté dorsal (mouvement de zip) pour former le tube à
l’origine de tout le système nerveux central.
Le mouvement de fermeture du tube va se produire plus tard au niveau de l’endoderme et
former le tube de l’endoderme.
- Maturation rostro-caudale :
La maturation se fait de la tête vers la queue.
A ce stade de développement, on n’a pas encore les bourgeons de membre, qui vont apparaître
autour des somites
Au niveau de la tête, la fusion des bourrelets neuraux a commencé ainsi que la migration des
CCN sous l’ectoderme.
Au niveau caudal, il n’y a pas encore de fusion des bourrelets.

La différenciation de ces plaques de l’ectoderme et gastrulation (mise en place du
mésoderme) continuent.
La fenêtre de superposition d’évènements dure 2 ou 3 semaines (période de la grossesse la
plus fragile).
- Induction de la plaque neurale et CN
Les CCN sont induites par des échanges de signaux entre la plaque et l’ectoderme non neural
adjacent.
La plaque neurale se fait induire parce qu’elle est superposée au notochorde.
Les coordonnées dorso-ventrales sont induites par Shh.
L’ectoderme latéral exprime des molécules de la famille des BMP (2,4 et 7)( peuvent
promouvoir la différenciation de l’os à partir d’autres sources de mésoderme?), qui vont être
contrées par des signaux sécrétés par le notochorde.
Ces molécules ( noggin, chordin) vont séquestrer le BMP et faire en sorte que la partie
médiane reçoive le moins de molécules possible, on crée ainsi un gradient.
Ensuite ça permettra la sécrétion de molécules MIT (très importantes, rôle majeur dans la
signalisation).
Rq : Wnt1/3a permettent aussi de repousser plaque neurale.
On a donc une cascade de molécules et un affinement des territoires de la plaque neurale.
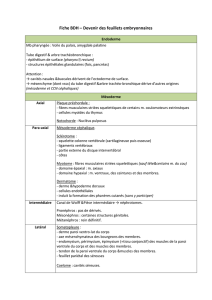
II. On distingue 4 classes de CCN :
1) MESECTODERME :cellules issues du mésenschyme provenant lui-même de la
différenciation d’ectoderme dents, crâne, arbre vasculaire , tendons, tissu conjonctif de la
face et visage, derme et adipocytes
La technique Quail-Chick chimera : des cellules issues d’une caille(donneur) sont greffées à
un poulet (receveur). On trace au microscope la migration des cellules de cailles facilement
individualisables par rapport à celles du poulet.
2) SYSTÈME NERVEUX PÉRIPHÉRIQUE :
neurones sensitifs, sympathique et parasympathique, ganglion rachidien, vague…
3) SYSTÈME ENDOCRINE :
médullosurrénale cellules chromaffines synthétisant noradrénaline, adrénaline, dopamine
BMP(4...)
Dlx5, Slug/Snail (bord de plaque)
Wnt1/3a,
Sox2
anti-BMP (noggin/chordin...?)

cellules parafolliculaires de la thyroïde sécrétion de calcitonine
glomus carotidien Ach
Les CCN sont indispensable au développement des glandes.
4) MÉLANOCYTES : des CCN pigmentées en multiplication donnent les mélanoblastes
d’abord situés dans le mélanoderme avant de pénétrer dans l’épiderme pour se différencier en
mélanocytes.
Effets indésirables sur l’organogénèse : thyroïde et parathyroïdes, glomus carotidien, tige
pituitaire, plexus choroïdes, glandes salivaires et lacrymales. En effet, les CCN constituent la
trame structurale pour la formation de l’hypophyse
SIGNATURE MOLÉCULAIRE DE CCN
Elle correspond aux gène candidats des maladies humaines
Il existe une certaine plasticité et évolution : certains gènes sont spécifique de l’espèce
humaine, d’autres sont conservées.
Les CCN ont un potentiel restreint selon leur diférenciation en CCN céphalique /troncale.
On ne sait pas si les CCN sont programmées à l’origine ou si leur devenir dépend des
intéractions avec le Système nerveux. Par ailleurs, en imposant son orientation rostrocaudale,
l’endoderme induit indirectement la différenciation des CCN.
Analyse sériée de l’expression génique dans les CN : on clone tous les transcrits présents
dans les CN puis on les séquence (chez la souris). On constate qu’un grand nombre de gènes
des précurseurs CN sont superposables chez l’Homme et qu’ils codent majoritairement des
facteurs de transcription (Hox…). On peut ensuite classer les gènes selon le nombre de tissus
où ils s’expriment pour connaître leur degré de spécificité (ubiquitaire ou CN spécifique).
Certaines CCN humaines restent à l’état de souche, ancrées dans les tissus. Il faut se rappeler
qu’elles n’ont pas la capacité de donner du muscle strié.
Chez l’Homme tous les composants de la signalisation sont présents mais pas chez la souris.
III.B°)
Rôle de HOX et FGF ;
Hox détermine le mésoderme de façon précoce, puis son devenir segmentaire.L’expression
précoce forcée de Hox entraîne un mavais développement du cartilage. Il y a conservation de
la colinéarité et de séquences.
Le gène Hox confère l’identité des segents aux parties du corps à partir du rhombencéphale :
ainsi une greffe de mésoderme garde son code Hox après transplantation ectopique, mettant
en évidence que les CN ne sont pas fixées dans leur devenir.
Les dérivés des CN troncales vont migrer de façon non segmentaire
SHH est reconnu par un récepteur « Patched », activant la transcription de gènes cibles
intervenant dans la formation des mâchoires, du cerveau antérieur.
Déficit en Vitamine A :
-malformation variable de l’œil, fente palatine, anomalies des gros vaisseaux du cœur
(cardiopathie conotroncales), hernie diaphragmatique.
Le taux d’acide rétinoïque est autorégulé de façon fine
Syndrome Matthew Wood :
-microphtalmie, cardiopathie, hernie diaphragmatique.
Malformations de la face ; fente labiopalatine, hypodontie, narine unique, hypotélorisme,
holoprosencéphalie( car formation visage et cerveau vont de pair)
Les malformations communes s’expliquent par le défaut des CCN.

Toutes les mutations somatiques chez l’embryon peuvent donner des tissus mosaïques
responsables de malformations congénitales sporadiques, qui peuvent réaliser des
phénocopies de maladies congénitales transmissibles.
Ccl° Les CCN sont :
- multipotentes,
- déterminées par des mécanismes autonomes et des mécanismes non autonomes
- et dont le devenir et la plasticité dépendent de leur coordonnées dans les 3
dimensions de l’espace et du temps
- les neurocristo pathies résultent de la perturbation de la maturation des CN ou
de ses dérivés.
1
/
5
100%