exercice 2 : evolution de la reaction de l`ammoniac avec l`eau

Réunion 2005 (6 POINTS)
EXERCICE 1 : EVOLUTION DE LA REACTION DE L'AMMONIAC AVEC L'EAU
Une bouteille d'ammoniaque du commerce comporte l'indication 22 ° Bé, ce qui correspond à une concentration molaire
C0 = 10,9 mol.L-1.
Cette solution sera nommée S0.
Dans une solution aqueuse d'ammoniac, l'équilibre entre l'ammoniac NH3 et les ions
ammonium NH4+ s'écrit : NH3 (aq) + H2O (I) = HO– (aq) + NH4+ (aq).
Données (valeurs à 25 °C):
Quotient de la réaction de l'ammoniac avec l'eau à l'équilibre : Qr,éq= 1,58.10–5
Produit ionique de l'eau : Ke = 1,00.10–14
1ère partie : Détermination du quotient de réaction par pHmétrie :
La « basicité » de la solution S0 étant trop élevée pour être mesurée directement au pHmètre, on prépare 50,0 mL d'une
solution diluée S1 de concentration C1 = C0 /10.
Le pH mesuré de S1 est 11,62.
1) Quel volume de la solution S0 doit-on prélever pour préparer la solution S1 ?
2) Proposer un mode opératoire pour préparer la solution S1.
3) Montrer que la concentration en ion hydroxyde dans la solution S1 est :
[HO– ](S1)= 4,2.10-3 mol.L-1
4) Compléter le tableau d'avancement donné en annexe pour la réaction de l'ammoniac avec l'eau dans la solution
S1 en considérant un volume V ’1 = 1,0 L.
5) En déduire la valeur du taux d'avancement final 1. Commenter le résultat obtenu.
6) Calculer le quotient de réaction Qr,1 à l'état final et montrer que le système est à l'équilibre aux incertitudes de
mesure près.
2ème partie : Détermination du taux d'avancement de la réaction de l'ammoniac sur l'eau par conductimétrie :
Valeurs des conductivités molaires ioniques à 25 °C :
°( HO–) = 19,9.10–3 S.m2.mol–1 °( NH4+) = 7,34.10–3 S.m2.mol–1
L’expression de la conductivité d'une solution = i [ Xi ] n'est valide qu'en solution très diluée. A partir de la solution S1
d'ammoniac, on prépare une solution fille, nommée S2 de concentration C2 = C1/100 = C0/1000 .
A) Hypothèse: On fait l'hypothèse que les quantités de matière des espèces en solution n'ont pas changé lors de la
dilution.
1) En déduire l'expression littérale de la concentration [HO– ](hyp) en fonction de [HO– ](S1), de même pour [NH4+](hyp)
en fonction de [NH4+] (S1) et [NH3] (hyp) en fonction de [NH3] (S1).
2) Montrer que le quotient de réaction Qr,hyp obtenu avec cette hypothèse est égal à Qr,1/100.
3) Le comparer à Qr,eq. En déduire si l'hypothèse est effectivement vérifiée.
Sinon dans quel sens évolue le système lors de la dilution ? Justifier.
B) Conductimétrie:
Pour confirmer ou infirmer l'hypothèse précédente, on mesure la conductivité de la solution S2: = 0,114 mS.cm–1.
1) Donner la valeur de dans le système international.
2) Exprimer la conductivité de la solution S2 en fonction des conductivités molaires ioniques et des concentrations
effectives [NH4+] (S2) et [HO– ](S2), dans cette solution.
3) En utilisant le tableau d'avancement de la réaction de l'ammoniac sur l'eau et les données du texte en déduire
[HO– ](S2),
4) Calculer le taux d'avancement final 2 de la réaction de l'ammoniac sur l'eau.
5) La dilution de la solution mère agit-elle sur le taux d'avancement de la réaction de l'ammoniac sur l'eau ? Si oui
dans quel sens. L'hypothèse émise dans la partie 1 est-elle confirmée ?

EXERCICE 2 : 2003 Antilles Condensateur d'un flash 4 points
On se propose d'étudier le fonctionnement d'un flash d'appareil photographique jetable. Pour obtenir un éclair de
puissance lumineuse suffisante, on utilise un tube flash qui nécessite pour son amorçage, une forte tension (au moins
250 V) pour émettre un éclair très bref. Pour stocker l'énergie nécessaire au fonctionnement du tube flash, on utilise un
condensateur de capacité C. Ce condensateur est chargé à l'aide d'un circuit électronique alimenté par une pile.
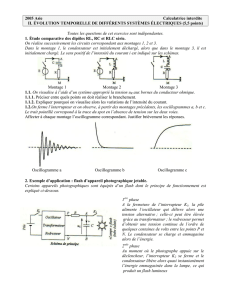
On schématise le fonctionnement de ce dispositif sur le schéma ci-dessous :
l'alimentation est assurée par une pile de tension continue U1 = 1,50 V;
un circuit électronique permettant d'élever la tension U1 à une tension continue U2 = 300 V.
un conducteur ohmique de résistance R = 1,00 k permettant la charge du condensateur de capacité C = 150 F
en plaçant l'interrupteur K2 en position 1 et en fermant l'interrupteur K1.
le tube flash qui est déclenché (une fois le condensateur chargé) en basculant l'interrupteur K2 en position 2.
1. Charge du condensateur :
On charge le condensateur en fermant l'interrupteur K1.
1.1. On donne l'expression de la constante de temps
= RC Vérifier par analyse dimensionnelle l'homogénéité de cette
formule.
1.2. Calculer numériquement.
1.3. Calculer l'énergie emmagasinée E par le condensateur de capacité C une fois la charge terminée à la tension U2.
1.4. En calculant l'énergie E' qu'aurait stockée le condensateur s'il avait été chargé directement à l'aide de la pile (tension
U1), justifier l'intérêt de charger le condensateur avec une haute tension de 300 V.
2. Décharge.
En plaçant l'interrupteur inverseur K2 sur la position 2 on provoque le flash grâce à l'énergie stockée dans le
condensateur.
On enregistre la tension u aux bornes du condensateur C (voir graphique en annexe).
2.1. Comparaison entre temps de charge et temps de décharge.
2.1.1. Déterminer graphiquement la constante de temps ' correspondant à la décharge en précisant la méthode
employée (l'annexe complétée sera rendu avec la copie).
2.1.2. Comparer les constantes de charge et de décharge '. Ce constat est-il en accord avec les conditions de
fonctionnement du tube flash ?
2.2. On assimilera, après son amorçage, le tube flash à un conducteur
ohmique de résistance r. À partir du schéma électrique ci-contre
montrer que l'équation différentielle de la décharge du condensateur à
travers un conducteur ohmique de résistance r est de la forme :
0.
.
1 u
Crdt
du
2.3. Vérifier que la solution est de la forme u = U0 exp ( -t / ' )
2.4. Que représente la tension U0 pour le fonctionnement du tube flash ?
2.5. Déterminer U0. Cette valeur est-elle en accord avec la production de l'éclair ?

ANNEXE DE L'EXERCICE 1
(A REMETTRE AVEC LA COPIE)
Tableau d'avancement exprimé en moles pour un volume V ’1 = 1,0 L.
Etat
Avancement
NH3 + H2O = HO– + NH4+
initial
0
n1 =
e
x
c
è
s
intermédiaire
x
final
xf =
maximal
xmax =
ANNEXE A RENDRE AVEC LA COPIE EXERCICE 2
1
/
3
100%