I. Barrières non spécifiques - Cours de DCEM1 2010/2011 à Amiens

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
IMMUNITE NON SPECIFIQUE – IMMUNITE INNEE
- Immunité innée : mécanismes mis en jeu immédiatement après la pénétration d’un pathogène
au sein de l’organisme afin de l’éradiquer ou de contrôler sa dissémination au site de l’infection.
- Mécanisme ancestral.
- Immunité non spécifique par opposition à l’immunité spécifique de l’antigène.
o Spécificité « large » de reconnaissance.
- Immunité innée par opposition à l’immunité adaptative : lymphocytes B et T.
o Pas de mémoire immunitaire.
o Les cellules répondent de la même façon lors d’une deuxième attaque par l’antigène.
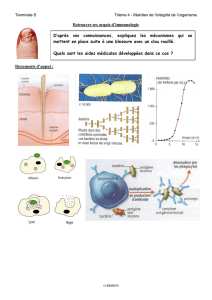
I. Barrières non spécifiques
- Portes d’entrée :
o Peau, voies digestives, respiratoires et génitales.
o Sang.
- Protections :
o Mécaniques :
o Cellules épithéliales.
o Mouvement ciliaires (voies respiratoires), péristaltiques (voies digestives,
empêche les bactéries de s’accrocher et envahir l’estomac).
o Chimiques :
o Acides gras.
o PH acide (estomac).
o Enzymes.
o Peptides antibiotiques.
o Biologiques : flore bactérienne commensale. L’organisme est colonisé par des milliards
de bactéries (peau, intestins, etc.) qui constituent une forme de protection par
compétition pour les nutriments contre les bactéries pathogènes.
II. Dynamique de la réponse immunitaire

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
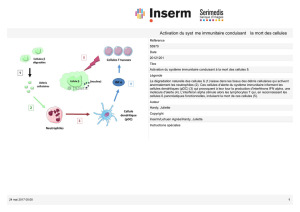
- Suite à l’invasion d’un pathogène il y a une réponse immunitaire innée rapide et locale. Dans la
majorité des cas elle est suffisante pour l’éradication du pathogène. Nous sommes quasiment
soumis ne permanence à ce type d’événements.
- Si elle ne suffit pas, il y a alors induction d’une réponse adaptative. En effet le système
immunitaire inné est nécessaire à l’induction de la réponse adaptative.
- La réponse adaptative répond de deux façons :
o Elle dispose de ses propres armes (anticorps, lymphocytes B et T).
o Une grande partie de son action est également de renforcer l’action du système
immunitaire inné.
- Reconnaissance de pathogènes par de facteurs solubles préformés et des cellules tissulaires
résidentes :
o Lyse directe.
o Action concertée :
o Réaction inflammatoire.
o Amplification par recrutement de nouveaux acteurs :
o Néo-synthèse de facteurs solubles.
o Recrutement de cellules circulantes.
o Amplification par augmentation des fonctions.
o Induction de la réponse immunitaire adaptative.
o Résolution de l’inflammation avec une réparation tissulaire. Résolution = terminaison
III. Reconnaissance des pathogènes
1. Ligands exogènes
- Ligands exogènes : reconnaissance de profils moléculaires associés aux microbes (PAMP :
Pathogen Associated Molecular Patterns) par des récepteurs de reconnaissance des profils
moléculaires (PRR : Pattern Recognition Receptors).
- Il existe plusieurs types de profils moléculaires associés aux pathogènes (PAMP) :
o Le système immunitaire est capable de reconnaitre un virus à ARN. Il ne sait pas lequel,
mais il sait que c’est un virus à ARN.
o Il en est de même pour les virus à ADN.
- Il existe un nombre limité de récepteurs de reconnaissance des PAMP (PRR), avec une 30aine de
récepteurs différents, l’organisme est capable de reconnaitre tous les pathogènes. Il en existe
deux types :
o Facteurs solubles.
o Récepteurs cellulaires.
a. PRR : facteurs solubles
- Facteurs solubles (molécules solubles dans la circulation) : collectines, pentraxines, complément.
o Sécrété par le foie, phagocytes, etc.
o Protéines de la phase aigue de la réponse inflammatoire.
- Récepteurs cellulaires (exprimés par des cellules spécialisées) sont de deux types séparés selon
leur fonction :
o Les récepteurs membranaires qui ont un rôle majeur dans la capture et la phagocytose

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
o Et ceux qui ont un rôle majeur dans la présentation antigénique et la sécrétion de
cytokines
b. PRR : récepteurs membranaires
- Les récepteurs membranaires :
o Lectines : liaisons à des sucres bactériens. Récepteur au mannose, β-glucane (DC SIGN ?
Dectin-1).
o Récepteurs scavengers : polymères anioniques. CD36, MARCO, SR-A, etc.
o Récepteurs opsonines : RFc, CR, MBL-R, etc.
- Rôle majeur dans la présentation antigénique et la sécrétion de cytokines.
o Toll-Like receptors (TLR) 1 à 11 : extra ou intracellulaires. Ils ont un rôle majeur dans
l’inductio nde la réponse adaptative.
o TLR2 : peptidoglycane, acide lipoteichoique, zymosan (constituant de la
membrane des levures, bactéries G+, etc.).
o TLR3 : ARN double-brins (Virus ARN).
o TLR4 : LPS (bactéries G-).
o TLR5 : flagelline (bectéries flagellées).
o TLR9 : CpG (nucléotides hypométhylés) (bactéries).
o Nucléotide oligomerization Domain-like Receptors (NLR) : intracellulaires.
o Nod1 et Nod2 : dérivés du peptidoglycane.
o Autres récepteurs extra ou intracellulaires.
- Expression différentielle des PRR (cellulaires) selon type cellulaire, localisation tissulaire, etc.
o Les phagocytes expriment de nombreux PPR.
Expression plus restreinte sur d’autres cellules : lymphocytes B, cellules épithéliales,
lymphocytes NK, etc.
o Collaboration/synergie des différents PPR.
2. Ligands endogènes
- Ligands endogènes : induction ou expression augmentée de ligands, et/ou modification de
structures existantes, par le stress cellulaire.
o Récepteur NK : ligands inductibles. C’est n’est pas une reconnaissance directe mais une
expression de nouvelles molécules à la surface de la cellule infectée, qui elles seront
reconnus par le lymphocyte NK.
o Récepteurs scavengers (CD36, MARCO) : LDL oxydées, cellules apoptotiques
(phosphatylsérine), etc.
o Autres : ligands endogènes rendus accessibles par la mort cellulaire tels que HMGB1,
HSP, etc.
IV. Phase soluble de la réponse innée
1. Collectines
- Collectines : protéines comprenant un domaine collagène et un domaine lectine capable de lier
des carbohydrates bactériens (sucres) mais pas de l’hôte (syalilation).

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
- Mannose-Binding Leptine (MBL).
o Protéines de synthèse hépatique : accrue par l’IL-6.
o Mannose microbiens.
o Opsonisation par des récepteurs de MBL (macrophages).
o Activation du complément par la voie des lectines.
- Pentraxines : CRP (C-reactive Protein).
o Protéine de synthèse hépatique.
o Protéine de l’inflammation marqueur (sensible, précoce, non spécifique).
o Se lie à des résidus phosphorylcholine de certaines bactéries et champignons.
o Opsonisation : pneumocoque. Si déficit en CRP, sensibilité au pneumocoque.
o Activation de la voie classique du complément.
2. Système du complément
- Système du complément :
o Ensemble de protéines plasmatiques (environ 5%) et tissulaires.
o Synthèse hépatique, cellules épithéliales, synoviales, monocytes, etc.
o Demi-vie brève, synthèse rapide et consommation permanente.
- Activation en cascade : la fixation du complément à certaines surfaces activatrices induit une
activité protéolytique vis-à-vis des protéines du complément, libérant d’autres composants à
activité protéolytique.
- Il existe trois voies d’activation du complément convergentes (elles convergent pour avoir une
activité commune).
- Ce système du complément est très efficace, donc il peut être très dangereux pour l’organisme, il
y a donc de nombreux mécanismes régulateurs.
- La première voie d’activation du complément est la voie classique :
o C1 présent dans la circulation sous forme inactive, un évènement le rend actif :
reconnaissance d’un complexe AC-AG. L’isotype particulièrement efficace pour activer la
voie classique est l’IgM (lié à un antigène).
o Il y a lors un système d’activation en cascade par clivage séquentielle. C1 actif clive C4
en :
o C4a : qui part dans la circulation.
o C4b : membranaire.
o Puis clivage de C2 en C2a et C2b (membranaire).
o Le complexe C4b-C2a membranaire devient une C3 convertase classique qui permet le
clivage de C3.
- La deuxième voie d’activation du complément est la voie des lectines.
- Il y a deux voies d’activations différentes au départ qui finissent toutes deux par un clivage de C3.

Immunologie – E. Treiner.
Cours d’Inès Masmoudi. DCEM1 2010-2011.
- La troisième voie d’activation du complément est la voie alterne :
o Activation directe par certaines surfaces : polysaccharides, zymosan, certains virus ou
cellules infectées, endotoxines bactériennes, etc.
o Elle repose sur un événement qui se produit en permanence dans la circulation : le
segment C3(soluble) se clive en C3a et C3b(soluble). Cette hydrolyse n’induit rien car ce
sont des faibles quantités C3b qui sont produites.
o Par contre quand il y a activation par des surfaces activatrices, le C3b devient
membranaire
o Elle converge également vers la production d’une C3 convertase.
- Convergences de voies classiques et alternes :
o L’ensemble du complexe C5b678(9)n forme le CAM : Complexe d’Attaque Membranaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%