Chimie08

NOM :
Prénom :
840906691 1
1. Le modèle de l’atome
La matière est constituée de « grains de matière » extrêmement petits : les atomes. Pour
décrire la constitution et la structure de l’atome, on peut utiliser un modèle simple.
L’atome est constitué d’un noyau sphérique central autour duquel les électrons sont en
mouvement.
Le rayon du noyau est environ 100 000 fois plus petit que celui de l’atome.
L’atome est donc essentiellement constitué de vide.
Le noyau est constitué de particules nommées nucléons. Il existe deux sortes de nucléons : les
protons et les neutrons.
Le noyau comporte A nucléons. Z protons et donc (A –Z) neutrons. Z est appelé numéro atomique.
A chaque valeur de Z correspond un élément chimique. Si on attribue à cet élément le symbole X,
le noyau de cet élément est noté :
Les masses des protons et des neutrons sont de 1,67.10-27 kg
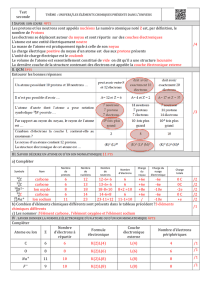
2. Le nuage électronique
Les électrons sont répartis en différentes couches notées K, L, M … de plus en plus éloignées du
noyau.
Les électrons se placent d’abord dans la couche K, puis dans la couche L lorsque la couche K est
saturée et ainsi de suite.
Couche
Nombre maximal d’électrons
K
2
L
8
M
8
La masse d’un électron est de 9,10.10-31 kg
3. Les isotopes
Deux isotopes sont des atomes d’un même élément chimique (nombre Z de protons identique)
mais qui possèdent des nombres de neutrons différents.
et sont deux isotopes de l’élément carbone.
4. Les ions
Le nuage électronique de l’atome de sodium (Na) comporte 11 électrons qui se répartissent ainsi :
2 électrons sur la couche K (saturée), 8 électrons sur la couche L (saturée) et un électron sur sa
couche électrique M.

NOM :
Prénom :
840906691 2
La formule électronique de cet atome est (K)2 (L)8 (M)1.
L’ion Na+ est un atome de sodium qui a perdu 1 électron.
L’ion Cl- est un atome de chlore qui a gagné un électron.
La charge élémentaire de l’électron et donc également du proton est de
1,60.10-19 C
Un ion cherche a reproduire la structure électronique du gaz noble dont il est le plus proche dans
le tableau de Mendeleïev.
5. Exercice
Quelle est la formule des ions fluorure, oxyde, sodium ?
1
/
2
100%