Techniques immunologiques I) La réaction antigène

Techniques immunologiques
I) La réaction antigène-anticorps
A) Caractéristiques
• Cette réaction est spécifique et met en jeu un paratope sur l'anticorps (région qui fixe l'antigène),
avec un épitope sur l'antigène (région reconnue par l'anticorps).
Un anticorps est spécifique d'un épitope d'un antigène sauf cas particulier.
En général, les épitopes reconnus par un lymphocyte B sont très hydrophiles.
Cet épitope peut être conformationnel (acides aminés qui se suivent dans la séquence primaire de la
protéine) ou non conformationnel (acides aminés non séquentiels). Dans les 2 cas, ce sont des
épitopes très extérieurs par rapport à la structure de la protéine et hydrophiles.
Il se peut qu'un épitope soit commun à 2 antigènes différents. Un anticorps commun à 2 antigènes
différents génère une réaction croisée: réaction dans laquelle un anticorps reconnaît un épitope
commun à 2 antigènes. C'est ce qu'il se produit dans les antigènes sanguins du groupe ABO: les
individus du groupe A produisent des anticorps contre les globules rouges du groupe B. Cette
production d'anticorps anti-B chez un individu A, est due au fait que les antigènes A-B sont des
oligosaccharides très proches de ceux produits par des bactéries de la flore intestinale.

• Elle est due à des forces de faible énergie:
- liaisons hydrogènes
- interactions ioniques
- interactions hydrophobes
- interactions de Van der Waals
• Cette réaction est réversible.
Cette réaction suit la loi d'action de masse. C'est une réaction équilibrée qui dépend de différentes
constantes.
k1/k2 = KA = constante d'association
KD = 1/KA = constante de dissociation = constante d'affinité
KD est exprimée en M et détermine l'affinité Ac – Ag. Plus le KD est petit, plus l'affinité est grande.
• L'affinité d'un anticorps pour un antigène est la force avec laquelle l'anticorps fixe l'antigène.
• L'avidité est la force avec laquelle un anticorps qui est multivalent (plus de 2 sites de liaison à
l'antigène, comme une IgM pentamérique) se lie à un antigène multivalent.
L'avidité dépend de plusieurs sites anticorps.
B) Définition d'un anticorps monoclonal/polyclonal

Si on immunise un lapin avec un antigène (= ensemble d'épitopes différents), il va développer une
réponse immunitaire contre cet antigène, qui va impliquer des lymphocytes B qui vont produire des
anticorps. Différents lymphocytes B spécifiques des épitopes de l'antigène vont réagir et vont
pouvoir devenir des plasmocytes. Si on prélève le sérum de cet animal, on va y trouver les anticorps
spécifiques du même antigène, mais d'épitopes différents. Si on prend l'ensemble de ces anticorps,
on a l'anticorps polyclonal.
Anticorps polyclonal = ensemble d’anticorps qui reconnaissent les épitopes différents d'un
même antigène.
Si on isole une des cellules qui produit un anticorps, on obtient un anticorps monoclonal.
Anticorps monoclonal = anticorps qui reconnaît qu'un seul épitope d'un antigène (sauf
réaction croisée)
II) Les réactions de précipitation
A) Principe
C'est la réaction entre un antigène soluble et un anticorps, soit dans une phase liquide, soit dans un
gel. Il va se former un complexe immun (complexe antigène-anticorps) qui est insoluble et qui va
donc précipiter.

Ce précipité va se former par l'apparition d'un réseau tridimensionnel d'antigènes reliés par des
anticorps. Pour que cette précipitation se fasse, il faut que l'anticorps utilisé soit au moins bivalent
(2 sites de liaison à l'antigène) et que l'antigène soit également au moins bivalent (2 fois le même
épitope).
Si on met des concentrations croissantes d'antigènes au contact d'anticorps, on aura 3 zones:
- zone d'excès d'anticorps, sans précipité (pas assez d'antigènes)
- zone d'équivalence: c'est là où il y a le plus de précipité. Ce sont les conditions optimales
pour qu'il y ait un précipité
- zone d'excès d'antigènes: les concentrations ne sont plus à l'équilibre, donc le précipité se
désagrège
B) Précipitation en milieu liquide: néphélémétrie
Elle nécessite un appareillage complexe contenant un rayonnement lumineux intense et
monochromatique, envoyé à travers un tube dans lequel sont mélangés les antigènes et anticorps. Il
va être diffracté et détecté par un détecteur. Plus on a de précipité, plus la lumière sera diffractée. La
quantité de lumière détectée sera proportionnelle à la quantité de précipité. Ca permet de réaliser un
dosage car la quantité de précipité dépend de la quantité d'anticorps mise dans la chambre, puis on
comparera avec une courbe étalon.
A la fin, c'est une lecture de densité optique qui dépend de la concentration en anticorps.
On l'utilise pour doser les immunoglobulines et les facteurs du complément.
C) Précipitation en milieu solide

L'antigène et l'anticorps vont être déposé en solution dans un puits creusé dans un gel (agar ou de la
gélose). L'anticorps et l'antigène diffusent de façon radiale autour du puits jusqu'à se rencontrer. Au
lieu de rencontre, il se forme un précipité appelé un arc de précipitation.
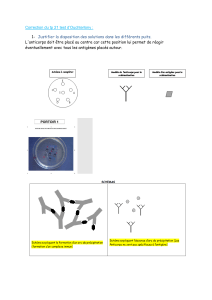
1) Immunodiffusion double: méthode d'Ouchterlony
Immunodiffusion double car l'anticorps et l'antigène migrent.
On peut utiliser des colorants comme le bleu de Coomassie (colorant des protéines).
Cette méthode est utilisée à l'hôpital pour détecter les auto-anticorps anti-nucléaires qu'on trouve
dans le sérum de certains patients (signe de certaines maladies auto-immunes).
Selon la forme des arcs, on peut déterminer la nature du complexe anticorps-antigène.
2) Immunodiffusion radiale: méthode de Mancini
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%