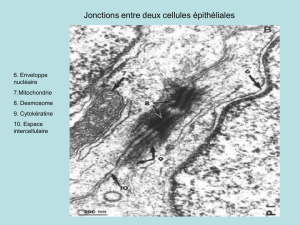
Motilité cellulaire

Motilité cellulaire
Les mouvements engagés dans le trafic intracellulaire ou dans la mise en place des compartiments
membranaires (cf. CELLULE), ou encore dans la ségrégation des chromosomes (cf. DIVISION
CELLULAIRE) impliquent tous d'une manière ou d'une autre des moteurs moléculaires spécialisés.
C'est aussi ce genre de module élémentaire qui sert de base aux structures contractiles des cellules
amiboïdes et des muscles, ainsi qu'aux structures vibratiles des flagelles et des cils.
Les biologistes représentent volontiers les moteurs, avec leur organisation le plus souvent
dimérique, et leur structure caractéristique en plusieurs domaines, la tête, la tige et la queue, comme
des équilibristes évoluant sur un fil grâce à un mécanisme qui ressemble à la marche dans le cas des
myosines, ou au glissement du skieur de fond dans le cas des kinésines et des dynéines. Ces images
naïves, mais parlantes, seront progressivement remplacées par des modèles plus réalistes et moins
intuitifs, qui prendront en compte des mesures expérimentales de plus en plus fines. Il faut s'attendre
cependant à de longues controverses avant qu'un modèle fasse l'unanimité, tant l'observation du
mouvement élémentaire d'un moteur individuel sur un filament et la mesure de l'énergie libérée sont
délicates.© Encyclopædia Universalis 2006, tous droits réservés
….
récemment, un modèle probabiliste a été proposé pour décrire le déplacement d'un moteur sur un
filament (figure 7). On a présenté ici ce modèle de manière très schématisée. L'idée centrale est que le
changement de conformation du moteur, lié à l'hydrolyse de l'ATP, modifie le potentiel d'interaction
entre le moteur et le filament. Pour simplifier, on peut considérer que ce changement de conformation
fait passer le moteur d'un état lié au filament à un état de libre diffusion dans le milieu environnant. On
peut aussi faire l'hypothèse que le potentiel d'interaction entre le moteur et le filament est périodique et
asymétrique, du fait de la périodicité et de la polarité structurale des polymères de tubuline ou d'actine.
Ainsi, quand le moteur se lie au filament, il se place au minimum local du potentiel d'interaction et y
demeure jusqu'à ce qu'il se détache. Il va alors diffuser librement sur une certaine distance, puis se lier
de nouveau. Si la distance de diffusion est inférieure à la période du potentiel d'interaction, il peut se
lier en arrière ou en avant du minimum local précédent. Dans le premier cas, il reviendra au même
endroit. Dans le second, en raison de l'asymétrie du potentiel d'interaction, il tombera dans le
minimum local suivant et aura donc avancé d'une unité de longueur. Il a donc une chance sur deux de
rester sur place et une chance sur deux d'avancer. S'il est resté sur place, le même cycle de dissociation
et de réassociation se produit, et l'on comprend que le moteur a une probabilité de plus en plus faible
de rester sur place (en 1/2n, où n est le nombre de cycles d'attachement-détachement). Les deux
paramètres très importants pour la validité de ce scénario sont les probabilités de passage d'un
potentiel à l'autre. Il faut que le moteur reste suffisamment longtemps attaché pour glisser jusqu'au
minimum local de potentiel et il ne faut pas qu'il reste trop longtemps détaché, sinon il diffusera sur de
trop grandes distances et perdra toute « mémoire » de l'endroit où il était attaché précédemment. Ce
modèle a été validé expérimentalement dans un système entièrement artificiel : des billes de latex ont
pu être transportées d'un point à un autre en sautant de manière probabiliste le long de surfaces
chargées de manière asymétrique et périodique.
Pour des raisons encore peu connues, les moteurs qui se déplacent sur les microfilaments
(myosines) et ceux qui se déplacent sur les microtubules (dynéines et kinésines) fonctionnent très
différemment : les myosines ne s'attachent que très peu de temps au microfilament, le temps de
produire une force appliquée quasi ponctuelle dans l'espace et le temps. En revanche, les kinésines et
les dynéines avancent sur de grandes distances sans se détacher du microtubule ; on dit de ces moteurs
qu'ils sont processifs. Ces comportements ont des conséquences très importantes sur les capacités
d'organisation des filaments par les moteurs. Par exemple, les myosines se décrochent sans cesse de
leur filament, pouvant même passer d'un filament à un autre, alors que les kinésines vont évoluer
jusqu'au bout du microtubule et y rester ancrées un certain temps. C'est cette différence qui explique la
capacité d'un gel d'actine et de myosine à se contracter (cas du muscle), alors que les kinésines en
interaction avec des microtubules vont organiser des asters (cas de la division cellulaire). De
nombreuses équipes, en physique comme en biologie, se penchent aujourd'hui sur les subtilités liées à
ces propriétés fines des interactions entre les moteurs et les polymères polarisés et sur la difficile
question de la conversion de l'énergie chimique de liaison de l'ATP en travail mécanique (production
de force). Les caractéristiques propres aux polymères sont évidemment fondamentales (rigidité,

longueur moyenne, dynamique de polymérisation). Mais les propriétés les plus étonnantes ne peuvent
être expliquées qu'en considérant des comportements collectifs, c'est-à-dire des assemblées de moteurs
agissant sur des filaments de manière coordonnée.
Cette coordination est réalisée dans des structures spécialisées dont les deux exemples les plus
courants sont la myofibrille et le flagelle des cellules eucaryotes dont on doit maintenant étudier le
fonctionnement.
© Encyclopædia Universalis 2006, tous droits réservés
Structures spécialisées
Les microfilaments d'actine et les microtubules peuvent participer à la production de mouvement de
trois manières différentes, qui sont probablement apparues séquentiellement au cours de l'évolution.
L'assemblage même des polymères représente la première manière de produire du mouvement. On
sait aujourd'hui que toute l'activité de déformation vers l'avant d'une cellule migratrice est due à
l'assemblage de polymères d'actine à l'avant de la cellule, et que des bactéries pathogènes se déplacent
dans les cellules en contrôlant à leur profit la polymérisation de l'actine. Dans le cas des microtubules,
il est possible que leur assemblage ou désassemblage contrôle certains mouvements des chromosomes
durant la mitose : la force développée par un microtubule qui pousse contre une paroi est de l'ordre de
quelques piconewtons.
L'utilisation de moteurs moléculaires individuels est la deuxième manière de produire du
mouvement. Elle est exploitée pour transporter des « cargos » de toute nature dans la cellule (figure 7),
ou pour produire une supra-organisation des polymères les uns par rapport aux autres.
Enfin, la production de mouvements rapides peut être obtenue grâce à des superstructures
spécialisées qui correspondent à des assemblages stables de polymères sur lesquels des moteurs
fonctionnent collectivement. Les exemples les plus achevés sont, d'une part, la myofibrille du muscle
et, d'autre part, le cil ou le flagelle des organismes unicellulaires eucaryotes ou des épithéliums ciliés
et des spermatozoïdes des métazoaires.© Encyclopædia Universalis 2006, tous droits réservés
La myofibrille musculaire
Les fibres des muscles squelettiques sont en fait des cellules géantes multinucléées issues de la
fusion de nombreuses cellules précurseurs. Elles peuvent atteindre chez l'homme une longueur de
50 centimètres et un diamètre de 50 micromètres et contiennent un système hypertrophié de
microfilaments d'actine et de moteurs de type myosine constitués en myofibrilles qui remplissent
pratiquement tout l'espace cellulaire (les noyaux sont repoussés sous la membrane plasmique). Chaque
myofibrille, longue structure cylindrique d'environ 1 micromètre de diamètre (figure 8), présente une
striation transversale caractéristique (à l'origine de l'appellation « muscle strié » pour les muscles
squelettiques ou cardiaques, par opposition aux « muscles lisses » des viscères, qui ont une
organisation différente). Les striations correspondent à un enchaînement de 10 000 à 20 000 unités
contractiles, ou sarcomères, qui mesurent environ 2,5 micromètres de longueur et sont constituées d'un
arrangement précis de microfilaments d'actine et de filaments épais, eux-mêmes constitués d'un
assemblage bipolaire de molécules de myosine. L'organisation bipolaire des filaments de myosine,
rendue possible grâce à l'association des molécules individuelles de myosine par leur partie rigide non
motrice, a pour effet de disposer les têtes motrices aux deux extrémités des filaments épais. Cette
organisation est la clé du fonctionnement des sarcomères. En effet, en présence d'ATP, les filaments
bipolaires de myosine, qui sont disposés longitudinalement dans la partie médiane du sarcomère,
peuvent glisser en même temps sur des filaments d'actine antiparallèles ancrés aux deux extrémités du
sarcomère. Ce glissement entraîne un raccourcissement du sarcomère, par un mouvement équivalent
des deux extrémités du sarcomère vers le centre, et constitue la base moléculaire de la contraction
musculaire. On peut aujourd'hui observer de manière très précise le raccourcissement, d'environ 20%,
de chaque sarcomère au cours de la contraction musculaire, et observer qu'il correspond bien à un
glissement des deux types de filaments les uns par rapport aux autres.© Encyclopædia Universalis
2006, tous droits réservés
Le cil ou le flagelle des cellules eucaryotes

Les cils et flagelles, appendices cellulaires fins et vibratiles, ont une structure interne, ou axonème,
très semblable dans toutes les cellules eucaryotes, des unicellulaires à l'homme. Les mécanismes à la
base du mouvement sont identiques, même si, en raison de leur différence de longueur, les cils, courts,
battent plutôt comme des fouets, et les flagelles, beaucoup plus longs, propagent des ondes
pratiquement sinusoïdales. L'axonème est essentiellement constitué de microtubules, dont la polarité (-
) vers (+) correspond à son axe proximo-distal, et son mouvement est généré par des moteurs de type
dynéine (figure 9)© Encyclopædia Universalis 2006, tous droits réservés
L'axonème est un cylindre de 0,2 micromètre de diamètre dont la paroi est formée de neuf
microtubules disposés selon une parfaite symétrie radiale et interagissant entre eux tangentiellement
par des « bras » qui correspondent à des rangées de moteurs de type dynéine. L'axe du cylindre est
constitué d'une paire de microtubules sur lesquels est fixé un empilement régulier de petits disques
protéiques inclinés à environ 15 degrés par rapport à l'axe. Cette structure centrale interagit avec la
structure tangentielle par neuf rangées de structures radiaires. Le motif structural (9 + 2) de l'axonème
des eucaryotes (9 microtubules périphériques + 2 microtubules axiaux) ne fut découvert qu'avec
l'avènement de la microscopie électronique. L'empilement régulier des différentes structures associées
aux microtubules peut avoir une période variable selon la structure considérée, ou l'espèce analysée,
mais celle-ci est toujours un multiple de 8 nanomètres, qui est la dimension longitudinale d'un
hétérodimère a-b de tubuline. Les microtubules apportent ainsi le motif structural au principe de la
construction de l'axonème : ils permettent de fabriquer un édifice complexe et motile sur de très
grandes longueurs. La structure des axonèmes a été décrite avec beaucoup de précision dans les années
1950, mais la manière dont le battement ciliaire ou flagellaire est contrôlé et parfaitement entretenu,
avec une fréquence allant de 10 à 50 hertz, reste largement incompris. Il est cependant établi que le
mouvement est généré par le glissement sur de petites distances des microtubules périphériques les uns
par rapport aux autres et qu'il peut être produit tout au long de l'axonème.© Encyclopædia
Universalis 2006, tous droits réservés
….
Remarquable pièce d'horlogerie, réclamant pour son mouvement une coordination dans les trois axes
(tangentiel, radial et longitudinal) qui défie l'entendement, l'axonème est capable de battre tout en
croissant. Il existe une coordination supplémentaire étonnante entre deux flagelles d'une même
cellule : chez les algues unicellulaires biflagellées telles que Chlamydomonas reinhardtii, on peut
casser expérimentalement l'un des deux flagelles. Dans ce cas, l'autre flagelle régresse en taille jusqu'à
atteindre la dimension du flagelle cassé. Après quoi les deux flagelles, qui n'ont pas cessé de battre,
repoussent de manière symétrique.
Michel BORNENS Matthieu PIEL © Encyclopædia Universalis 2006, tous
droits réservés

Le mouvement est, avec la capacité de reproduction, l'une des propriétés qui définissent le vivant. Au
niveau cellulaire, certains mouvements peuvent être observés à l'aide du microscope optique
conventionnel, tandis que d'autres se produisent à une échelle de dimension quasi moléculaire et
requièrent des microscopes plus perfectionnés. En effet, les structures spécialisées dans la production
de mouvement, comme la myofibrille du muscle ou le flagelle du spermatozoïde, sont de véritables
automates moléculaires dont les dimensions ne sont que légèrement supérieures à celles des
macromolécules qui les constituent.
Les bases mécano-chimiques des mouvements cellulaires reposent toutes sur l'utilisation d'un
nucléotide, adénosine triphosphate (ATP) ou guanosine triphosphate (GTP), dont l'hydrolyse contrôlée
fournit l'énergie nécessaire au mouvement. La liaison entre deux phosphates attachés à ces molécules
représente donc la source universelle d'énergie dans le vivant.
Dans le présent article, nous nous limiterons à l'étude des événements accessibles à l'observation
directe. Après avoir caractérisé l'ordre de grandeur des mouvements à l'échelle du vivant, on
examinera les principaux modes de locomotion au niveau cellulaire, c'est-à-dire la nage et la reptation.
Cela nous amènera à nous interroger sur les problèmes comportementaux que cette locomotion révèle :
les réponses aux signaux ont-elles un intérêt adaptatif qui puisse compenser leur coût énergétique par
rapport à un déplacement au hasard ?© Encyclopædia Universalis 2006, tous droits réservés
1. Rapidité du phénomène
La gamme de vitesse des mouvements observés dans le vivant est très large. Les cellules qui nagent
en milieu liquide se déplacent à des vitesses comprises entre 0,1 et 1 millimètre par seconde. Les
cellules qui migrent sur une surface sont beaucoup plus lentes, se déplaçant de 0,01 micromètre par
seconde pour un fibroblaste, à 0,1 micromètre par seconde pour le leucocyte neutrophile du sang. Des
amibes sont capables de se déplacer beaucoup plus rapidement, dépassant 10 micromètres par seconde.
Les structures subcellulaires spécialisées dans la motilité peuvent produire des mouvements
beaucoup plus rapides. La propagation de l'onde de battement d'un cil ou d'un flagelle chez les
eucaryotes est de l'ordre du millimètre par seconde, alors qu'un muscle ou certaines structures
contractiles primitives peuvent se contracter à des vitesses de l'ordre de 10 à 100 millimètres par
seconde. C'est avec de telles performances au niveau des structures élémentaires qu'un champion de
course de vitesse peut se déplacer à une vitesse de l'ordre de 10 mètres par seconde, grâce à la
coordination de ses muscles assurée par le système nerveux ; c'est également le cas des animaux
sélectionnés au cours de l'évolution sur leur aptitude à la course, comme le guépard pour capturer ses
proies, ou le cheval pour fuir ses prédateurs. Ce principe de coordination des actions qui permet
d'augmenter les performances lorsqu'on assemble des structures élémentaires est valable à toutes les
échelles, des molécules aux organismes.© Encyclopædia Universalis 2006, tous droits réservés
Les mouvements intracellulaires se produisent également sur une échelle importante de vitesse. Le
transport axonal lent des neurones a une vitesse de l'ordre de 0,01 micromètre par seconde, et le
transport rapide de l'ordre de 1 micromètre par seconde. Le mouvement des chromosomes durant
l'anaphase a une vitesse intermédiaire. Certains mouvements intracellulaires peuvent être beaucoup
plus rapides, dans des cellules spécialisées comme les mélanophores ou les érythrophores, grâce
auxquels certains animaux, comme les poissons, peuvent rapidement changer de couleur pour se
confondre avec l'environnement : le mouvement des corpuscules chargés de pigments peut y dépasser
10 micromètres par seconde. Il en va de même pour les courants cytoplasmiques de certaines cellules
géantes d'algues, pouvant atteindre une taille de quelques millimètres à plusieurs centimètres. Les
courants cytoplasmiques internes de l'amibe Physarum sous sa forme plasmode sont plus rapides
encore et peuvent atteindre une vitesse de 1 millimètre par seconde.© Encyclopædia Universalis
2006, tous droits réservés
La locomotion cellulaire
La nage
Les cellules ont une taille qui va du micromètre pour une bactérie (ou cellule procaryote) à quelques
dizaines de micromètres pour les cellules eucaryotes (dont l'ADN est isolé du cytoplasme par une
enveloppe). Elles sont donc soumises à des contraintes physiques très différentes de celles que peuvent
subir des organismes multicellulaires de grande taille : la viscosité de l'eau domine la physique de leur

mouvement, alors que c'est l'inertie qui domine celle des organismes. Les cellules doivent, pour se
déplacer, s'appuyer en permanence sur l'eau qui les entoure. Elles possèdent pour cela des structures
spécialisées, les flagelles ou les cils, dont les mouvements sont entretenus par des mécanismes très
différents selon qu'ils appartiennent à des bactéries (procaryote) ou à des cellules eucaryotes©
Encyclopædia Universalis 2006, tous droits réservés
Les procaryotes
Les bactéries sont si petites (1 micromètre de longueur) qu'elles sont soumises de manière violente à
l'agitation thermique du milieu (mouvement brownien). Elles sont pourtant capables de se diriger vers
des sources de nourriture ou d'éviter des conditions d'environnement adverses, en se déplaçant à la
vitesse considérable, pour leur taille, de 20 à 30 micromètres par seconde. Le plus souvent, elles le
font en utilisant des flagelles, qui fonctionnent comme une hélice de bateau. Dans la bactérie
intestinale Escherichia coli, par exemple, chaque flagelle est un filament rigide de 14 millièmes de
micromètres de diamètre et de 10 micromètres de longueur, qui tourne à la vitesse incroyable de
quelque 200 tours par seconde grâce à un petit moteur rotatif inséré dans la membrane et la paroi de la
cellule. Le flagelle ayant une forme d'hélice droite, sa rotation, dans le sens des aiguilles d'une montre
lorsqu'on regarde de la bactérie vers le flagelle, produit une poussée sur le milieu qui entraîne le
déplacement de la bactérie dans le sens opposé à la poussée. Les différents flagelles coopèrent pour
produire un mouvement rectiligne de la bactérie, en formant une tresse unique compatible avec la
forme en hélice droite des flagelles et avec leur rotation individuelle. Un tel mouvement dure de
l'ordre de la seconde, après quoi la cellule change brutalement, et au hasard, de direction en pivotant
sur place, grâce à une inversion du sens de rotation des flagelles, qui est incompatible avec le maintien
d'une organisation des flagelles en une tresse unique produisant une traction. Une modification de la
fréquence des changements de direction de la bactérie provoquée par les signaux de l'environnement
auxquels elle est sensible lui permet de se diriger.© Encyclopædia Universalis 2006, tous droits
réservés
Les unicellulaires eucaryotes
De très nombreuses espèces unicellulaires eucaryotes se déplacent grâce à des ciliatures ou à des
appareils flagellaires d'une très grande variété, parfois constitués de plusieurs milliers de cils ou de
flagelles. Cependant, tous les cils et tous les flagelles possèdent, à de rares exceptions près, une
structure de base identique, reposant essentiellement sur des microtubules [cf. CELLULE] . Les cils
ou les flagelles des cellules eucaryotes sont fondamentalement différents des flagelles bactériens, par
leur taille, au moins dix fois supérieure en diamètre, par leur fonctionnement et par le fait que, tout en
se projetant à l'extérieur du corps cellulaire, ils restent entourés de la membrane plasmique et sont
donc des organites intracellulaires, au contraire du flagelle bactérien. La distinction entre cil et flagelle
chez les eucaryotes repose sur leur type de battement et non sur leur structure. La différence entre les
battements des cils et des flagelles explique que les flagelles soient souvent nettement plus longs que
les cils. Les flagelles poussent ou tirent le corps cellulaire grâce à des trains d'ondes symétriques qui se
propagent d'une extrémité à l'autre. Les cils fonctionnent davantage comme des rames, ou comme les
bras d'un nageur, et ont un mouvement asymétrique, dans lequel on peut distinguer une phase active
d'appui sur le liquide environnant, et une phase de récupération qui ne produit pas de mouvement. Ces
battements ciliaires ou flagellaires ne sont pas entièrement stéréotypés car les protozoaires sont
capables d'une grande variété de comportements en fonction des conditions d'environnement.
Considérons deux exemples, l'un chez les ciliés et l'autre chez les flagellés.
La nage des cellules se produit grâce à une coordination du battement des cils ou des flagelles. Le
déplacement de la cellule dans une direction donnée s'accompagne souvent d'une rotation lente du
corps cellulaire. C'est le cas pour la paramécie, cellule ovoïde de plus de 100 micromètres de longueur
qui possède plusieurs milliers de cils distribués de manière régulière en rangées longitudinales (le long
de méridiens). Le battement est synchrone d'une rangée de cils à l'autre dans la direction transversale
mais possède un léger déphasage le long d'une rangée, ce qui provoque une onde métachronale en
spirale à la surface de la cellule qui se traduit par une lente rotation. La paramécie face à un obstacle
peut modifier sa trajectoire en renversant, sous le contrôle d'un signal calcique, le battement de ses
cils, ce qui a pour effet de la faire reculer. Puis le battement ciliaire s'interrompt transitoirement sur
toute la surface de la cellule, sauf dans l'orifice buccal, très riche en cils et placé en position
asymétrique à l'avant de la cellule. Cela produit une rotation de l'axe du corps cellulaire. Lorsque le
battement normal reprend, la direction du mouvement avant fait un angle de plusieurs dizaines de
 6
6
 7
7
 8
8
 9
9
1
/
9
100%