TP n°1

Quand on éclaire un prisme avec de la lumière blanche, on observe qu’elle est :
…………………………………………
…………………………………………
La figure observée sur l’écran à la sortie du prisme (à reproduire en annexe) est appelée
………………………. de la lumière.
un peu d’histoire des sciences
Aristote contre Newton !
Le phénomène que vous avez observé a été expliqué de manière différente par Aristote et Newton
Quand on éclaire un prisme avec de la lumière issue d’un laser, on observe qu’elle est :
…………………………………………… mais pas ……………………………………
Une lumière MONOCHROMATIQUE (appelée aussi RADIATION) n’est pas décomposée par un
prisme. Elle est caractérisée par un nombre appelé LONGUEUR D’ONDE DANS LE VIDE.
La longueur d’onde est notée par la lettre lambda : et son unité dans le système international est
le mètre. En pratique, on utilise souvent le nm ( = …….. m)
Une lumière ………………………………………….. est composée de plusieurs radiations (donc de
longueurs d’onde différentes)
Principe de fonctionnement d’une lampe à incandescence : quand on applique une tension aux bornes de la lampe,
un courant circule dans le filament qui s’échauffe (effet Joule). Il émet alors de la lumière.
Diriger la lumière blanche issue de la lampe à incandescence (alimentée par une tension de 6V) vers le prisme placé
au centre du disque. Observer l’allure du spectre.
A l‘aide du rhéostat, diminuer la tension à 0V, puis augmenter progressivement sa valeur jusqu’à 6V : observer
attentivement l’évolution des spectres obtenus.
Découper les 3 spectres donnés en annexe (bas de la feuille) et coller chaque spectre sous la photo correspondante :
photo 1 photo 2 photo 3
La lumière est blanche et les couleurs naissent progressivement de son
affaiblissement dans le prisme. Un rayon blanc traversant le prisme se
colore de rouge du côté de l'arête et de bleu du côté de la base car les
épaisseurs traversées sont différentes.
Je pense plutôt que la lumière blanche du soleil est un mélange de lumières
de toutes les couleurs et le prisme dévie différemment ces diverses
lumières. La preuve : je suis capable de recomposer la lumière blanche en
mélangeant des lumières de couleur différente !
Aristote (IV siècle avant JC)
Isaac Newton, dans les années 1660 (il avait alors 18 ans !)
RETENIR

Compléter les phrases suivantes à l’aide de mots choisis dans la liste suivante (certains mots de cette liste ne seront
pas utilisés !) : augmente - diminue – continu(e) – spectre – température – masse – chaud – froid – violet – rouge :
Un corps ………….. émet de la lumière dont le ………………. est ………………………… : il contient
une suite …………………….………… de radiations colorées.
Ce spectre change avec la …………………………………. du corps : quand elle
……………..……….., il s’enrichit vers le ……………..
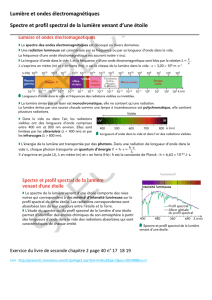
Spectre d’émission
Principe de fonctionnement d’une lampe spectrale : on réalise des
décharges électriques dans un gaz (composé d’atomes ou d’ions) sous
faible pression. Le gaz émet alors de la lumière.
Observer le spectre d’une lampe à vapeur de mercure avec un
spectroscope.
Quelle est la différence entre ce spectre et un spectre d’origine thermique ? ………………………………………….
……………………………………………………………………………………………………………………………………..
A l’aide de l’animation en ligne http://www.ostralo.net/3_animations/swf/spectres_abs_em.swf, afficher le spectre
d’émission du mercure (symbole Hg), retrouver les longueurs d’ondes des raies observées et reproduire ce spectre
sur l’annexe. Faire de même pour le spectre d’émission de l’atome d’hydrogène.
Un gaz à faible pression et à température élevée émet une lumière dont le spectre est constitué
de quelques raies colorées sur un fond noir : SPECTRE DE RAIES D’EMISSION.
Ces raies sont CARACTERISTIQUES de l’entité chimique (ion ou atome) présente dans le gaz.
Leur longueur d’onde permet d’identifier cette entité.
Spectre d’absorption
On éclaire un gaz à basse pression et basse température par de la
lumière blanche. On réalise le spectre de la lumière à sa sortie du gaz. .
Une partie de la lumière esr absorbée par le gaz : il s’agit d’un spectre
d’absorption.
A l’aide de l’animation en ligne http://www.ostralo.net/3_animations/swf/spectres_abs_em.swf, afficher le spectre
obtenu après la traversée du gaz mercure sous forme atomique. Comparer au spectre d’émission du mercure. Le
reproduire (les 4 principales raies) sur l’annexe.
Utiliser l’animation pour observer les spectres d’émission et d’absorption de l’atome d’hydrogène (les reproduire en
annexe), puis d’autres atomes ou ions :
pour des atomes ou ions différents, les raies ont des longueurs d’onde ……………………………….
MAIS pour un même atome ou ion, les raies d’émission et d’absorption ont des longueurs d’onde ………………
Le SPECTRE D’ABSORPION d’une entité chimique est constitué de raies noires sur le fond
coloré d’un spectre continu. ELLES ONT LES MEMES LONGUEURS D’ONDE QUE LES RAIES
D’EMISSION : ces raies sont CARACTERISTIQUES de l’entité contenue dans le gaz et
permettent de l’IDENTIFIER.
RETENIR
RETENIR
RETENIR

en nm
400 450 500 550 600 650 700 750 800
en nm
400 450 500 550 600 650 700 750 800
en nm
400 450 500 550 600 650 700 750 800
en nm
400 450 500 550 600 650 700 750 800
en nm
400 450 500 550 600 650 700 750 800
1
/
3
100%