Classe de Seconde Thème : La santé Activité du Chapitre 4 : Des

Classe de Seconde Thème : La santé
Activité du Chapitre 4 : Des atomes aux ions.
Objectifs : Comprendre la composition d'un atome et sa symbolisation (A,Z)
Comprendre la structure électronique d'un atome (couches K, L et M)
Comprendre l'évolution électronique d'un atome vers celle d'un ion positif ou négatif.
Matériel : - plateau à godets (plateau à oeufs).
- des bouchons rouges (8) pour représenter les protons (+).
- des bouchons bleus (20) pour représenter les électrons (-).
- des bouchons blancs (8) pour représenter les neutrons.
- le tableau (ou extrait) de la classification périodique.
I) Composition d'un atome et symbolisation
Tout atome est composé de :
- protons (p) : ils habitent dans le noyau et sont au nombre de Z = numéro atomique.
Ce numéro atomique caractérise l'élément chimique. C'est le n° de la case occupée par
l'atome dans le tableau périodique. Les atomes y sont rangés par ordre de Z croissant.
Chaque proton (p) porte une charge électrique élémentaire (+ e).
- neutrons (n) : ils habitent eux aussi dans le noyau. Leur nombre peut varier (isotopes = même Z, mais A ≠ ).
Ils ne portent pas de charge électrique.
Le nombre cumulé de protons (p) et de neutrons (n) constitue le nombre de nucléons A. C'est la population totale des
particules présentes dans le noyau d'un atome. A = Z + n
d'où la symbolisation de l'atome :
- électrons (e-) : ils forment le nuage électronique autour du noyau. Dans un atome, leur nombre est égal à
celui des protons ( Zp => Ze- ).
Chaque électron (e-) porte une charge électrique (- e).
L'égalité numérique entre les protons et les électrons et leur égalité de charge élémentaire de signe opposé assurent la
neutralité électrique de tout atome : Z x (+e) + Z x (-e) = 0
1°) L'élément Carbone (C) :
a) Repérer le numéro atomique de l'élément Carbone dans la classification périodique.
b) En déduire le nombre de protons et les visualiser dans le plateau à godets.
c) Y placer ensuite le nombre d'électrons correspondant afin d'assurer la neutralité électrique de l'atome.
2°) L'élement Oxygène (O) :
Faire de même.
3°) L'élément Azote (N) :
On donne Z (N) = 7 et A = 14
a) En déduire la symbolisation du noyau d'un atome d'azote.
b) Placer dans le plateau à godets, les nombres respectifs de protons, neutrons et électrons de cet atome.
4°) L'élement Lithium (Li) :
Faire de même sachant que A = 7.

- 1 -
II) Structure électronique d'un atome
La population des Z électrons d'un atome se répartit dans différentes zones de l'espace autour du noyau. Ces zones sont
appelées couches électroniques :
La première couche électronique (notée K) est la plus proche du noyau. Elle peut contenir au maximum 2 e-,
après quoi, elle est saturée => règle du duet.
La deuxième couche électronique (notée L) peut contenir jusqu'à 8 e- => règle de l'octet.
La troisième couche électronique (notée M) est saturée si elle contient 18 e- . Cependant, son remplissage n'est
régulier qu'avec 8 e- .
La structure (ou formule ou répartition) électronique est donc prévisible pour tout atome tel que 1 ≤ Z ≤ 18.
Elle s'écrit alors sous la forme suivante pour Z (Bore) = 5 : (K)2 (L)3.
La dernière couche occupée s'appelle la couche externe.
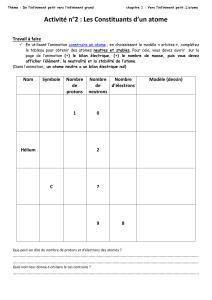
1°) A l'aide du plateau à godets, visualiser la répartition électronique des éléments suivants et en donner la formule
électronique. Compléter le tableau ci-dessous :
Elément
Symbole
chimique
Numéro
atomique Z
Nombre
d' e-
Structure
électronique
Hydrogène
Hélium
Carbone
Azote
Oxygène
Fluor
Néon
Sodium
Magnésium
Aluminium
Soufre
Chlore
Argon
Potassium
Calcium
2°) Observer les lignes grisées de ce tableau. Elles correspondent à des atomes particuliers appelés « les gaz rares » (ou
gaz nobles) .
a) Que constatez-vous ?
b) Quelle est leur position dans le tableau périodique ?
3°) De même, observer dans le tableau périodique, la position de tous les autres éléments nommés ci-dessus. Les
repérer les uns par rapport aux autres dans leur ligne (période) et dans leur colonne (famille).
a) Que peut-on dire de la couche externe de deux ou plusieurs éléments d'une même colonne ?
b) Que peut-on dire de la couche externe d'éléments situés sur une même ligne en les considérant de la gauche vers la
droite ?

- 2 -
III) Evolution de la structure électronique d'un atome vers celle d'un ion
Définition : Un ion est le résultat de la transformation d'un atome par gain ou par perte d'un ou plusieurs électrons.
Lors de cette transformation, le noyau est inchangé : le nombre de protons dans l'ion est le même que dans l'atome
correspondant.
Principe d'évolution : L'évolution d'un atome vers un ion est guidée par les règles du duet et de l'octet. L'atome va
perdre ou gagner des électrons de telle sorte que la couche externe de l'ion soit saturée.
Conséquence : L'ion formé est alors plus stable que l'atome car il est à présent aussi stable que le gaz noble qui le
précède (si perte d'e-) ou qui le suit (si gain d'e-).
A) Formation d'un ion positif :
1°) Dans le plateau à godets, visualiser :
a) les protons du noyau d'un atome de sodium (Na)
b) les électrons de son nuage électronique.
2°) Quelle est la structure électronique de l'atome de sodium ?
3°) Pour satisfaire à la règle de l'octet, comment va évoluer l'atome Na ?
4°) Quel est le bilan global des charges électriques après évolution ?
5°) Donner la formule de l'ion sodium.
6°) Proposer une généralisation pour tous les éléments de la première colonne du tableau périodique.
7°) Procéder de la même façon avec l'atome de Magnésium (Mg) et généraliser à sa colonne.
B) Formation d'un ion négatif:
1°) Dans le plateau à godets, visualiser :
a) les protons du noyau d'un atome d'Oxygène (O)
b) les électrons de son nuage électronique.
2°) Quelle est la structure électronique de l'atome d'Oxygène ?
3°) Pour satisfaire à la règle de l'octet, comment va évoluer l'atome d'Oxygène ?
4°) Quel est le bilan global des charges électriques après évolution ?
5°) Donner la formule de l'ion oxygène.
6°) Proposer une généralisation pour tous les éléments de la 16ième colonne du tableau périodique.
7°) Procéder de la même façon avec l'atome de Chlore (Cl) et généraliser à sa colonne.
Bilan de cette activité : L'essentiel par le schéma :
- 3 -
1. L'atome
ATOME = noyau (p, n) + nuage électronique (e-)
CHARGE de l'atome = 0 car Z (+e) + Z(-e) = 0
Symbolisation : A ZX avec Z p et A = Z + n
2. L' ion positif
Pour se stabiliser, l'atome perd un ou plusieurs électrons.
Le nombre de protons positifs est alors supérieur au nombre
d' électrons négatifs. La charge globale est positive.
Exemples : H+ , Na+ , K+, Mg2+ , Ca2+, Al3+, ......
3. L'ion négatif
Pour se stabiliser, l'atome gagne un ou plusieurs électrons.
Le nombre d'électrons négatifs est alors supérieur au nombre de
protons positifs. La charge globale est négative.
Exemples : F- , Cl- , O2-, S2- ........
1
/
3
100%