Xeroderma Pigmentosum (XP) - Raymond Rodriguez SVTperso

Xeroderma Pigmentosum (XP)
Autosomal récessif; q2 = 0,4/100 000.
Clinique :
héliosensibilité --> érythème sévère --> lésion dyschromiques --> cancers cutanés.
photophobie.
troubles neurologiques.
Risque néoplasique :
tumeurs cutanées et oculaires multiples dés l'âge de 8 ans (zones exposées au soleil).
Cytogénétique :
taux normal de cassures et d'échange de chromatides.
hypermutabilité cellulaire aux UV.
Gènes :
9 groupes de complémentation. Gènes ERCC (excision repair cross complement) et
XP (ex: XPAC ) : nombreux et disséminés sur différents chromosomes; rôle dans la
réparation DNA (hélicases) et dans un complexe réparation DNA/facteurs de
transcription.
B.1. Xéroderma pigmentosum :
Maladie héréditaire à transmission autosomique récessive, fréquente en Tunisie,
caractérisée par une sensibilité pathologique aux ultraviolets, liée à un déficit
des systèmes enzymatiques de réparation de l'ADN altérés par les rayons
ultraviolets. Se manifeste par la survenue précoce des lésions actiniques : dans
les premiers jours de la vie, on note un érythème de la face avec lésions vésiculo-
bulleuses des parties découvertes (coup de soleil), apparaissent ensuite des
lentigines, de l'atrophie et des télangiectasies réalisant un état poïkilodermique.
Sur ce fond se greffent vers l'âge de 5-6 ans des lésions kératosiques,
pseudoangiomateuses et papillomateuses avec ectropion des paupières et
photophobie marquée. Apparaissent ensuite des épithéliomas spino et
basocellulaires. Le pronostic du xéroderma pigmentosum est sombres, la mort
survenant généralement dans le bas âge, avant 20 ans. Il existe une forme dite
xéroderma pigmentosum variant ou "xérodermoïde" chez le sujet plus âgé et qui

s'exprime par des signes de photosensibilisation et l'apparition de cancers de
façon plus tardive.
Conduite à tenir : devant un xéroderma pigmentosum : photo protection
rigoureuse. Destruction des lésions tumorales dès leur apparition. Le traitement
préventif des cancers par la prescription des rétinoïdes systémiques est discuté.
Maladie pigmentaire épithéliomateuse
Affection héréditaire très rare, qui porte également le nom de xéroderma
pigmentosum ou de mélanose lenticulaire progressive. Elle se manifeste par des
cancers cutanés multiples, se développant pendant l’enfance. Le xeroderma
pigmentosum se transmet génétiquement suivant une mode récessif, c’est-à-dire que
le gène * porteur doit être reçu du père et de la mère pour que l’enfant développe la
maladie.
Cette affection est généralement due à une incapacité de l’ADN à réparer les lésions
secondaires à une exposition aux rayonnements solaires.
Elle se caractérise par un érythème (coloration rouge de la peau) et des tâches
contenant des pigments à la surface de la peau, puis par une sécheresse et une
atrophie de celle-ci, où apparaissent des tâches sans pigments et des
télangiectasies (dilatation des capillaires). Une atteinte des yeux, se traduisant par
une difficulté à regarder la lumière, une kératite (inflammation de la cornée), des
troubles nerveux sont fréquents.
Il existe une forme appelée forme de Santis Cacchione où existe un retard mental.
L’apparition de ces multiples tumeurs cutanées de nature maligne entraîne
habituellement la mort dans l’enfance ou dans l’adolescence. Une recherche
chromosomique est possible.
*gène : unité située sur l’A.D.N. qui, portée par les chromosomes, conserve et
transmet les propriétés héréditaires des êtres vivants.
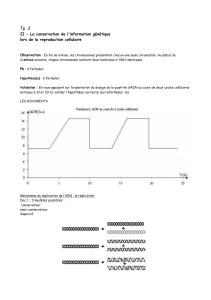
Les agents génotoxiques (certains composés chimiques, les rayonnements ultraviolets,...)
engendrent dans l’ADN une variété de lésions qui sont normalement éliminées par les
systèmes de réparation. Cependant, certaines lésions persistent, interfèrent avec la réplication
de l’ADN et peuvent ainsi induire des mutations à l’origine d’un mécanisme de
cancérogenèse. Pour étudier ce processus, l’équipe animée par Agnès Cordonnier, au sein du
Laboratoire de cancérogenèse et mutagenèse moléculaire et structurale (CNRS, Strasbourg)
dirigé par Robert P. P. Fuchs, s’est intéressée à la maladie génétique Xeroderma pigmentosum
variant (XPV), qui constitue un système modèle. En effet, le mécanisme qui permet aux
cellules normales de tolérer les lésions, c’est-à-dire de dupliquer l’ADN endommagé sans
accumuler de mutations, semble déficient chez les patients XPV, qui présentent une forte
probabilité de développer des cancers cutanés dans les zones de la peau exposées au soleil.

Afin d’étudier les mécanismes de " tolérance des lésions ", les chercheurs de Strasbourg ont
développé, en collaboration avec l’équipe du Dr Alan Lehmann à l’Université de Sussex à
Brighton (Grande-Bretagne), un test de réplication in vitro d’ADN endommagé dans des
extraits de cellules provenant d’individus normaux ou XPV. Ce test montre clairement que les
cellules XPV présentent une déficience non seulement quantitative mais aussi qualitative dans
leur capacité à effectuer la synthèse d’ADN en face d’une lésion. Ce test devrait permettre
d’isoler le facteur XPV par une approche biochimique de fractionnement et d’en préciser la
nature moléculaire. Une meilleure compréhension des différents systèmes de réplication, qui
jouent un rôle fondamental pour maintenir l’intégrité du génome, est attendue de ces travaux.
Le matériel génétique de toute cellule est soumis en permanence à l’action d’agents
génotoxiques provoquant l’apparition de lésions dans l’ADN. Le système de réparation par
excision de nucléotides ou NER (Nucleotide Excision Repair) est l’un des principaux
mécanismes qui permettent de restaurer l’intégrité du génome en éliminant les dommages de
l’ADN. L’importance de ce système est révélée par la maladie génétique Xeroderma
pigmentosum ou XP. En effet, chez les personnes atteintes, une déficience dans le système
NER se traduit par l’accumulation de mutations dans l’ADN entraînant un risque deux mille
fois plus élevé que la normale de développer des tumeurs cutanées dans les zones de la peau
exposées au soleil. Pourtant une proportion importante (~ 30 %) des malades souffrant de XP
ne présentent pas de défaut dans la réparation par excision mais présentent un défaut dans la
réplication de l’ADN endommagé. Bien qu’il s’agisse d’une maladie différente sur le plan
mécanistique, de ce fait appelée XP variant (XPV), elle se caractérise, comme la forme
classique, par une extrême sensibilité au soleil. Les chercheurs du Laboratoire de
cancérogenèse et mutagenèse moléculaire et structurale (CNRS, Strasbourg) se sont ainsi
intéressés à la maladie XPV pour étudier la réplication de l’ADN endommagé et caractériser
les facteurs mis en jeu dans le mécanisme de tolérance des lésions chez les eucaryotes
supérieurs.
Dans les années 1975, des études avaient montré que la synthèse d’ADN après irradiation aux
ultraviolets (UV) des cellules XPV est retardée par rapport aux cellules normales. Par ailleurs,
les fibroblastes, cellules du tissu conjonctif, issus de ces malades sont " hypermutables "
(fortement sujets aux mutations) après irradiation aux UV et le spectre des mutations induites
est différent de celui obtenu dans les cellules normales. L’ensemble de ces données suggère
que l’un des mécanismes de réplication de l’ADN endommagé est déficient chez les malades
XPV. Plusieurs hypothèses peuvent être émises :
1) dans les cellules XPV, l’un des mécanismes de contournement fidèle est déficient et seule
la synthèse d’ADN en face de la lésion, potentiellement mutagène, fonctionne dans la
réplication ;
2) en absence du facteur XPV (ou en présence d’un facteur déficient), la machinerie
réplicative qui effectue la synthèse en face de la lésion est plus mutagène que dans les cellules
_normales dans lesquelles le facteur XPV est présent.
La vérification de ces hypothèses est rendue difficile du fait de la présence, chez les
eucaryotes, d’un grand nombre d’unités de réplication, activées à des moments différents. Par
ailleurs, la nature, le nombre et le siège des lésions ne sont pas contrôlés par les
expérimentateurs. En particulier, le traitement des cellules aux rayonnements UV engendre
dans l’ADN toute une variété de lésions qui ne se forment pas avec la même efficacité.
Pour étudier de façon plus fine les mécanismes de " tolérance des lésions ", les chercheurs de
Strasbourg ont développé un test de réplication in vitro d’ADN endommagé dans des extraits

fibroblastiques d’individus normaux ou XPV. La lésion modèle utilisée est induite par un
cancérogène chimique puissant, l’acétylaminofluorène (AAF). L’ADN servant de matrice est
une molécule simple brin fermée contenant une lésion unique localisée en un site défini. Le
blocage de l’élongation au niveau de la lésion et le passage au-delà de celle-ci sont quantifiés.
L’utilisation d’ADN simple brin, par rapport au double-brin, présente l’avantage de permettre
d’analyser exclusivement le passage à travers la lésion. En effet, l’absence du deuxième brin
rend impossible les mécanismes de contournement de la lésion. De plus, dans un système
utilisant de l’ADN double-brin, le brin non endommagé est préférentiellement répliqué,
rendant difficile l’interprétation des résultats.
Ces travaux montrent que la présence de l’AAF inhibe l’élongation des amorces d’ADN.
Dans les extraits de cellules normales, une synthèse est néanmoins observée en face de la
lésion, représentant jusqu’à 50 % de la synthèse d’ADN en absence de lésion. Dans les
extraits de cellules XPV, la synthèse en face de la lésion est 10 fois moins efficace. Ces
résultats ont été obtenus pour 4 lignées de cellules normales et 5 lignées de cellules XPV. Ils
indiquent clairement que les cellules XPV présentent une déficience au point de vue non
seulement quantitatif mais aussi qualitatif, dans leur capacité à effectuer la synthèse en face
d’une lésion. Ces résultats ont également été confirmés par une analyse « en aveugle » dans
laquelle 4 lignées codées ont été correctement identifiées. Le mélange 2 à 2 des extraits
cellulaires provenant de 5 patients différents ne permet pas de restaurer la synthèse d’ADN en
face de la lésion. Ceci suggère que la même fonction est altérée chez ces différents patients
qui porteraient donc une mutation sur le même gène.
Ces résultats révèlent l’importance biologique du processus de synthèse d’ADN en face d’une
lésion, puisqu’une déficience dans ce mécanisme provoque l’apparition de cancers chez les
patients XPV. Cela semble a priori paradoxal, étant donné qu’une baisse de la capacité à
effectuer la synthèse en face d’une lésion devrait aboutir à une diminution de la fréquence de
mutagenèse. Ce paradoxe peut s’expliquer par le fait que, dans les cellules XPV, le passage
d’une lésion est non seulement plus difficile, mais surtout qualitativement différent,
provoquant ainsi une fréquence de mutagenèse accrue. Afin de tester cette hypothèse, les
chercheurs envisagent d’élargir cette étude à différentes lésions, notamment des lésions
induites par les UV. Cela permettra de confirmer le caractère hypermutateur de la machinerie
de franchissement des lésions en absence du facteur XPV. On peut imaginer que le facteur
XPV est une ADN polymérase spécialisée dans le franchissement des lésions. Cette ADN
polymérase permettrait dans les cellules normales un franchissement plus fidèle de certaines
lésions induites par le rayonnement UV que dans les cellules XPV.
La prochaine étape consiste à purifier le facteur XPV (et cloner le gène correspondant) à partir
d’extraits de cellules normales. Le test biochimique mis au point par l’équipe d’Agnès
Cordonnier permet d’envisager la purification du facteur XPV dont on suivra l’activité par
complémentation d’extraits XPV déficients. Cette étude permettra une meilleure
compréhension des différents systèmes de réplication qui jouent un rôle fondamental pour le
maintien de l’intégrité du génome en dépit de la présence de lésions sur l’ADN.
Cordonnier A. M., Lehmann A. R. and Fuchs R. P. P. (1999).
Impaired translesion synthesis in Xeroderma Pigmentosum variant extracts,
Mol. Cell. Biol., 19 (3) : 2206-11.
1
/
4
100%