N. Verbruggen

2e année du grade d’Ingénieur Agronome
Cours BOTA 002 – Bases moléculaires et génétiques du développement végétal
N. Verbruggen
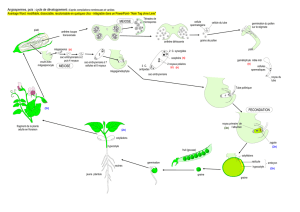
« Phytochrome controls the number of endoreduplication cycles in the Arabidopsis
thaliana hypocotyl » Gendreau et al., 1998.
The Plant Journal 13(2) : 221-230.
Résumé de l’article :
- La majorité des cellules de l’hypocotyle ont subi une endoréduplication.
- La lumière joue un rôle important dans le nombre d’endocycles :
maximum 2 cycles d’endoréduplication se passent à la lumière alors qu’à l’obscurité
30% des cellules entrent dans un troisième endocycle.
L’article montre que :
1. Pendant la germination, 2 endocycles ont lieu avant toute expansion cellulaire
2. A l’obscurité, le 3e cycle est terminé très tôt pendant la croissance cellulaire
3. Une mutation qui réduit de manière dramatique la taille des cellules n’interfère pas avec le
3e endocycle
4. Le troisième endocycle est tout à fait supprimé en lumière FR par l’action du
phytochrome A et dans une moindre mesure, à la lumière R par l’action du phytochrome
B
5. L’hypocotyle du mutant hy4 (cryptochrome) à la lumière blanche est 3x plus long que
celui du sauvage sans modification de la ploïdie.
En conclusion, l’inhibition du 3e endocycle dans les hypocotyles à la lumière n’est pas une
conséquence d’un simple feed-back liant le nombre de cycles au volume cellulaire mais est
une part intégrale du programme photomorphogénique contrôlé par les phytochromes.

INTRODUCTION
Endoréduplication : amplification du génome en absence de mitose
Dans les plantes, dans la plupart des cellules différenciées, des endocycles ont eu lieu.
Rôles proposés :
- favorise l’élongation cellulaire
- augmentation du nombre de copies de gènes importants
- barrière pour la division cellulaire
Dans Zea mays, l’endocycle est lié à l’inhibition de la cascade de phosphorylation contrôlant
la progression en mitose, en supprimant l’action du MPF.
Ici, Gendreau et al. démontrent que l’endoréduplication peut être découplée au moins
partiellement dans l’espace et le temps, de l’élongation cellulaire.
RESULTATS
1. Endoréduplication dans les hypocotyles à la lumière et à l’obscurité
L’hypocotyle est choisi comme système expérimental car son nombre de cellules est
déterminé au niveau de l’embryon. Il n’y a quasi plus de divisions cellulaires.
- Mesure du contenu en ADN par cytométrie de flux (Figure 1 a et b)
Le contenu en ADN des noyaux de l’hypocotyle d’Arabidopsis thaliana (écotype columbia,
lignée diploïde) est mesuré en les marquant au DAPI (4,6-diamino-2-phenylindole)
- à la lumière : 2C 4C 8C
noyaux des cellules
de l’hypocotyle - à l’obscurité : 2C 4C 8C 16C
A l’obscurité, dans les hypocotyles de plantules étiolées, il y a un troisième endocycle qui
n’est pas présent dans les cellules d’hypocotyles de plantules cultivées à la lumière.

Est-ce que les cellules mesurent leur taux de ploïdie en mesurant le nombre de copies du
génome ou le nombre d’endocycles ? utilisation d’un écotype d’Arabidopsis 4n
pas de différence dans le nombre d’endocycles
à l’obscurité, on observe des cellules « 4C 8C 16C 32C »
(Figure 1 c et d)
Conclusion :
Les cellules de l’hypocotyle mesurent le nombre de cycles de réplication du DNA plutôt que
le contenu nucléaire.
2. Contrôle spatial de l’endoréduplication
Localisation des cellules et des types de noyaux dans les tissus de l’hypocotyle
Microscope mesure du contenu en DNA dans les cellules individuelles dans des
hypocotyles marqués au DAPI :
- cortex
- épiderme
- endoderme
- cylindre central
Même pendant la croissance secondaire de
l’hypocotyle, les cellules retiennent une aptitude à se diviser
dans le cylindre central 1-2% cellules mitotiques
Figure 2 :
Epiderme et cortex pas de divisions cellulaires de l’épiderme, les mitoses sont restreintes
aux cellules qui vont donner les stomates (<1%).
Les noyaux les plus larges sont dans les cellules corticales et dans celles de l’épiderme (8C à
la lumière, 16C à l’obscurité).
Les noyaux les plus petits sont dans l’endoderme et le cylindre central (2C à la lumière et 2-4
C à l’obscurité).
Conclusion :
Dans l’hypocotyle, les endocycles sont localisés principalement dans les cellules du cortex et
de l’épiderme.

3. Contrôle de l’endoréduplication dans le temps
Evolution de la ploïdie pendant le développement de l’hypocotyle (Figure 3).
Dans un embryon mature, on trouve seulement des cellules avec des noyaux 2C.
1 jour après l’induction de la germination, la synthèse d’ADN est très active noyaux 4C et
8C alors qu’aucun signe de croissance n’est encore visible.
Après 1 jour, dans le cortex et l’épiderme où les cellules ne vont plus se diviser pendant le
développement de l’hypocotyle, la présence de noyaux 4C et 8C est le résultat d’endocycles.
l’endoréduplication a précédé la croissance cellulaire.
Après 2 jours, premiers signes de différenciation morphologique entre les 2 programmes du
développement :
2C ; 8C/4C dans la lumière
2C ; 8C et 16C dans l’obscurité.
3 - 5 jours, croissance exponentielle de l’hypocotyle et le rapport des noyaux 16C/8C
augmente à l’obscurité
Donc,
1) L’endoréduplication précède la croissance cellulaire.
2) Les cellules 16C apparaissent très tôt dans le développement.
3) Les endocycles ont lieu pendant toute la période de croissance de l’hypococtyle
.

4. Relation avec la taille de la cellule
Est-ce que le nombre de cycles est toujours corrélé au volume de la cellule ?
Figure 4 :
cpm 17, un mutant « brassinostéroïde » avec un hypocotyle court à l’obscurité ne présente
Pas d’étiolement, mais bien un profil d’endoréduplication presque normal, 20% de cellules
16C.
Volume cellulaire dans l’épiderme des hypocotyles à la lumière (où pas de 16C) volume
cellulaire à l’obscurité (voir tableau 2).
Donc, dans ce mutant, il n’y a pas d’étiolement, pas volume mais bien 3 cycles
d’endoréduplication.
Conclusion :
Les niveaux d’endoréduplication ne sont pas corrélés à la taille des cellules par un simple
mécanisme en feed-back.
5. La régulation par la lumière
La lumière inhibe un 3e endocycle par un mécanisme qui n’implique pas le contrôle de
l’expansion cellulaire.
Rôles des phytochromes
Le schéma expérimental suivant est illustré à la figure 5.
Différents génotypes sont mis à germer dans différentes conditions de lumière.
 6
6
1
/
6
100%