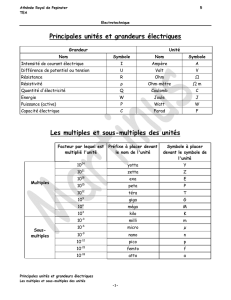
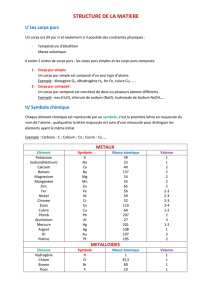
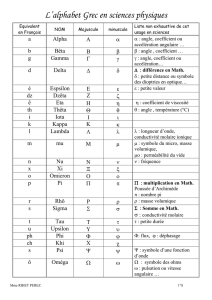
chap2-classification_elements_1s

1
1S Cours chimie
chap 2 : LA CLASSIFICATION PERIODIQUE des ELEMENTS
Pendant des siècles, savants, penseurs et philosophes ont considéré que la matière était constituée à partir de
quatre éléments : l’eau, la terre, l’air et le feu. Aujourd’hui, on compte en réalité 118 éléments qui sont
classés dans un tableau appelé Classification Périodique des Eléments (CPE). Quel est l’intérêt de cette
classification ? Sur quels critères repose-t-elle ? Toutes ces questions trouveront une réponse dans ce chapitre.
I. D’où viennent les éléments chimiques ? Compléter les trous
Quelques vidéos pour comprendre :
Mendeleïev
Formation de l’univers (7min07) : http://www.universcience-vod.fr/media/1139/il-etait-une-fois-la-matiere.html?spage=2&search=Big%20bang
Formation du système solaire et de la Terre (4min10) : http://www.universcience-vod.fr/media/1140/il-etait-une-fois-la-terre.html?page=4&tag_id=6
Fabrication des éléments chimiques (5min34) : http://www.universcience-vod.fr/media/1138/au-coeur-des-etoiles.html?page=2&tag_id=422
Origine :
L’hydrogène et l’hélium (en grande partie) ont été fabriqués au moment du …………………………….
Les autres éléments sont fabriqués au cœur des ………………………. dans des réactions thermonucléaires (jusqu’au fer)
Au-delà du fer, les éléments plus lourds sont fabriqués pendant l’explosion des …………………………. et disséminés dans
l’espace.
Des chiffres et des lettres… http://www.elementschimiques.fr/?fr/proprietes/abondances
https://fr.wikipedia.org/wiki/Abondance_d'un_%C3%A9l%C3%A9ment_chimique
et https://fr.wikipedia.org/wiki/Abondance_des_%C3%A9l%C3%A9ments_dans_la_cro%C3%BBte_terrestre
L’univers est constitué de nombreux objets,
de composition et de propriétés très
différentes : étoiles, planètes entourée de
satellites et d’anneaux, comètes, nuages
interstellaires…
Malgré cette diversité, deux éléments sont
très majoritaires dans l’univers. Quels sont-
ils et quel est leur pourcentage atomique et
massique ?
Nom élément
symbole
Pourcentage
atomique
Pourcentage
massique
*
*
La Terre possède différentes parties : le
noyau central, entouré par le manteau
sur lequel repose la croûte terrestre (ou
lithosphère).
La lithosphère représente les continents
et les mers et océans. Elle est
surmontée de l’atmosphère.
Quels sont les 3 principaux éléments de
la croûte terrestre et leur pourcentage
massique ?
Nom élément
symbole
Pourcentage
massique
*
*
*
Quels sont les 3 principaux éléments du
corps humain et leur pourcentage
massique ?
Nom élément
symbole
Pourcentage
massique
*
*
*

2
II. Historique : répondre aux questions
http://culturesciences.chimie.ens.fr/content/la-classification-periodique-de-lavoisier-a-mendeleiev-1229
Ou : https://fr.wikipedia.org/wiki/Tableau_p%C3%A9riodique_des_%C3%A9l%C3%A9ments
1. Nommez les principaux scientifiques qui ont contribué à l'élaboration du tableau périodique jusqu'à nos jours.
2. Sur quels critères est basée la classification de Mendeleïev ?
3. Quelle famille chimique est absente du tableau original de Mendeleïev ? Comment expliquez-vous cette absence ?
4. Mendeleïev était convaincu de l'existence d'éléments alors inconnus. Expliquez cette conviction en relation avec son tableau.
5. Ces éléments ont-ils été découverts (si oui quel est leur nom) ?
6. Combien d'éléments étaient connus en 1790? En 1869? Et aujourd'hui ?
7. Quel est le nom de l'élément no 101? Quelle est l'origine de ce nom ?
III. Culture générale (site de votre choix…)
8. Quel est l’élément découvert le plus tôt ? (année ou période)
9. Quel est l’élément découvert le plus tard ? (année)
10. Trouver l’étymologie (origine du nom) de 10 éléments dont le nom évoque une couleur. Donnez vos résultats dans un tableau.
Eléments :
Symbole + Nom
Etymologie
Couleur
Eléments :
Symbole + Nom
Etymologie
Couleur
11. Trouver 20 éléments dont le nom évoque une personne (réelle ou mythique) :
Eléments :
Symbole + Nom
Nom de la
personne
Eléments :
Symbole + Nom
Nom de la
personne
Eléments :
Symbole + Nom
Nom de la
personne

3
12. Trouver 20 éléments dont le nom évoque un lieu :
Eléments :
Symbole + Nom
Lieu
Eléments :
Symbole + Nom
Lieu
Eléments :
Symbole + Nom
Lieu
13. Trouver 6 éléments dont le nom évoque un astre :
Eléments :
Symbole + Nom
Astre
Eléments :
Symbole + Nom
Astre
Eléments :
Symbole + Nom
Astre
IV. La classification moderne http://www.elementschimiques.fr/?fr/proprietes/electroniques/bloc
1) Principe de la classification
Les éléments chimiques sont classés par numéros atomiques Z croissants et une nouvelle ligne est utilisée chaque fois que le
remplissage électronique fait intervenir une nouvelle couche. LIGNE = COUCHE
2) Description
Les lignes horizontales sont appelées périodes et sont numérotées de 1 à 7.
Les colonnes verticales sont appelées familles (ou groupes chimiques) et sont numérotées de 1 à 18 (ou par des symboles IA, IIA,
IIB…).
a) Les périodes
Les 3 premières périodes ne font intervenir que les sous-couches s et p.
La 1ère période ne comporte que les 2 éléments de la couche K : H et He.
La 2ème période ne comporte que les 8 éléments de la couche L : Lili Becqueta Bien Chez Nos Oncles Florien et Nestor.
La 3ème période ne comporte que les 8 premiers éléments de la couche M : Napoléon Mangea Allègrement Six Poulet
Sans Claquer d’Argent
A partir de la 4ième période le remplissage des sous-couches d, f … intervient
b) Les familles
La colonne n°1 (groupe I A) correspond à la famille des …………………….….. qui s’ionisent facilement en M+ pour adopter la
structure électronique du gaz noble le plus proche en perdant 1 e- (couche et/ou sous-couche saturée).
Alcalins
H
Li
Na
K
Rb
Cs
Fr
Cations
H+
Li+
Na+
K+
Rb+
Cs+
Fr+
La colonne n°2 (groupe II A) correspond à la famille des ……………………………………. qui s’ionisent facilement en M2+
pour adopter la structure électronique du gaz noble le plus proche en perdant 2 e- (couche et/ou sous-couche saturée).
Alcalino-terreux
Be
Mg
Ca
Sr
Ba
Ra
Cations
Be2+
Mg2+
Ca2+
Sr2+
Ba2+
Ra2+

4
La colonne n°17 (groupe VII A) correspond à la famille des …………………………….. qui s’ionisent facilement en X- pour
adopter la structure électronique du gaz noble le plus proche en gagnant 1 e- (couche et/ou sous-couche saturée).
Halogènes
F
Cl
Br
I
At
Anions
F-
Cl-
Br-
I-
At-
La colonne n°18 (groupe VIII A) correspond à la famille des ……………………………… (gaz rares, gaz inertes) dont les
couches et/ou sous-couches électroniques sont saturées et qui de ce fait ne réagissent quasiment pas chimiquement.
Gaz nobles
He
Ne
Ar
Kr
Xe
Ra
Remarques :
1. Les groupes I A et II
A (colonnes 1 et 2)
correspondent à des
éléments qui possèdent
des e- sur leur dernière
sous-couche s.
2. Les groupes III A, IV
A, V A, VI A, VII A, et
VIII A (colonnes 13 à
18) correspondent à des
éléments qui possèdent
des e- sur leur dernière
sous-couche p (sauf He).
3. Les groupes III B, IV
B, V B, VI B, VII B, et
VIII B (colonnes 3 à 12)
correspondent aux
éléments de transition
qui possèdent des e- sur
leur dernière sous-
couche d.
4. Les éléments de la série Z = 58 à 71 (lanthanides) ainsi que les éléments de la série Z = 90 à 103 (actinides) correspondent à des
éléments qui possèdent des e- sur leur dernière sous-couche f.
3) Familles et propriétés chimiques
Trouver la structure électronique des atomes Li, K, Be, Sr, Cl et I dans leur état fondamental et dessiner les cases quantiques de la
dernière sous-couche remplie d’e-.
Compléter la phrase :
« Les éléments d’une même famille possèdent la structure électronique de leur dernière couche …………..…………… : ils ont
alors le …………….………… d’e- périphériques sur leur couche externe répartis ………………………………….. dans une
sous-couche de …………………. nom ».
Puisque les réactions chimiques ne mettent en jeu que les e- périphériques, il en résulte que les éléments d’une même famille
(atomes, isotopes, ions monoatomiques et autres corps composés qui les contiennent) ont des propriétés chimiques semblables.
Vidéos expériences alcalins : http://www.dailymotion.com/video/x5axor_video-brainiac-metaux-alcalins-eau_tech

5
V. Propriétés physiques des éléments liées au numéro atomique Z
De nombreuses propriétés physiques des éléments dépendent de leur structure électronique et donc varient avec Z.
1) Les rayons atomiques et ioniques
a) Rayons atomiques (barrer les réponses inutiles) :
Dans une famille (colonne pour ceux qui dorment…), chaque élément possède : une couche / sous-couche / case quantique
/ case en moins de plus que celui qui est : au-dessus / au dessous de lui.
Le rayon atomique diminue / augmente donc lorsque Z augmente (de haut en bas) ».
Dans une période (ligne pour ceux qui se
sont rendormis), le nombre de couches
diminue / augmente / est constant
mais le nombre d’e- diminue / augmente
/ est constant lorsque Z augmente tout
comme le nombre de protons.
La force d’attraction entre le noyau et les e-
diminue / augmente donc aussi.
Ainsi le rayon atomique diminue /
augmente lorsque Z augmente (de gauche
à droite) ».
Vérifier vos réponses sur le graphe de droite.
b) Rayons ioniques (barrer les réponses
inutiles) :
Les anions ont perdu / pas de chance / gagné des e- par rapport aux atomes neutres : leurs rayons sont alors plus
gros / petits que ceux des atomes correspondants.
Les cations en ont perdu / raz le bol / gagné des e- par rapport aux atomes neutres : leurs rayons sont alors plus
gros / petits que ceux des atomes correspondants.
Vérifier vos réponses : R(F) = 64 pm et R(F-) = 136 pm / R(Al) = 125 pm et R(Al3+) = 50 pm
c) Tendance générale
Compléter le schéma de gauche par deux flèches (une par trait).
Rem : les éléments de transition ne respectent pas toujours cette
tendance générale.
2) Energie d’ionisation et Affinité électronique
a) Energie d’ionisation (Ei) (barrer les réponses inutiles) :
Pour former un cation, on ajoute / arrache un ou plusieurs e- à l’atome, il faut donc lui fournir de l’énergie. Cette énergie est
appelée énergie d’ionisation (Ei). Les e- les plus faciles à ajouter / arracher sont les e- les plus loin / proches du noyau,
donc les e- des couches de nombre quantique principal n le plus grand / petit.
H
Fr
He
R
R
 6
6
 7
7
 8
8
 9
9
1
/
9
100%