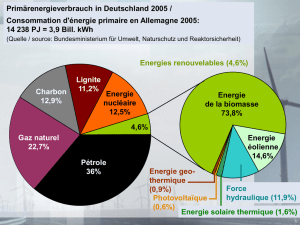
Physique, Chapitre 6

- 1/5 -
Physique, Chapitre 7 PREMIERE S
TRANSFERT D’ENERGIE ET ENERGIE INTERNE
I – ENERGIE INTERNE D’UN SYSTEME
1°) Nécessité de définir un système
2°) Energie interne d’un système
Le système est un solide en interaction avec la Terre. Outre la variation de l’énergie potentielle de
pesanteur, de l’énergie cinétique du solide ou de la somme des deux, le travail des forces extérieures au
système peut avoir divers effets :
modifier la température du système
entraîner un changement d'état
Pour prendre en compte ces effets, on utilise l'énergie interne notée U.
3°) Définition de l'énergie d'un système
II – LE TRANSFERT THERMIQUE PAR CHALEUR
1°) Définition
Lorsque deux corps à des températures différentes sont mis en contact, on constate que la température du
corps chaud diminue, tandis que celle du corps froid augmente. L'énergie interne du corps chaud décroît,
celle du corps froid croît. Il y a transfert d'énergie entre les deux corps : c'est le transfert thermique noté Q
en Joule (J).
2°) sens du transfert thermique
Lorsque deux système à des températures différentes sont directement en contact ou relié par un
conducteur thermique, le transfert thermique s'effectue spontanément du système dont la température est
la plus élevée vers le système dont la température est la plus basse.
Un système peut échanger de l'énergie avec l'extérieur par transfert thermique. L'énergie transférée est la
chaleur échangée par le système avec l'extérieur. C'est une grandeur algébrique. Elle est notée Q est
exprimée en joule.
Si le transfert thermique s'effectue de l'extérieur vers le système, la température du système est
inférieure à celle de l'extérieur alors le système reçoit de l'énergie par transfert thermique
alors
0Uet0Q
.
Si le transfert thermique s'effectue du système vers l’extérieur, la température du système est
supérieure à celle de l'extérieur alors le système cède de l'énergie par transfert thermique
alors
0Uet0Q
.
Lorsque l'extérieur et le système sont à l'équilibre thermique, leurs températures sont égales :
0Q

- 2/5 -
3°) Modes de transfert thermique
a) Transfert thermique par conduction, sans transport de
matière
Définition
Plaçons la pointe d'un long clou sur la flamme d'un bec Bunsen. Très rapidement, l'autre extrémité, la tête
du clou devient très chaude. Le transfert d'énergie calorifique se fait par conduction, sans transfert de
matière.
La flamme a augmenté l'énergie cinétique de vibration des ions fer et l'énergie cinétique désordonnée des
électrons libres. Cette agitation s'est propagée, par chocs successifs, depuis la pointe du clou, jusqu'à la
tête.
Conducteur thermique
Lorsque deux corps, dont les températures ne sont pas égales, sont mis en contact de thermique par
l'intermédiaire d'un solide, il y a transfert d'énergie par conduction thermique entre les deux corps.
L'importance de ce transfert thermique est fonction de la conductivité thermique du solide.
C'est ainsi qu'il existe des conducteurs thermiques et des isolants thermiques.
b) Transfert thermique par convection, avec transport de
matière
Les molécules d'air (dioxygène, diazote, etc.) présentes au dessus d'une plaque chauffante ou d'un
radiateur s'échauffent et montent vers le plafond de la salle. Il y a une circulation d'air qui s'établit des
parties chaudes de l'air vers les parties froides (la masse volumique de l'air diminue avec la température).
Cette circulation peut être rendue visible avec un peu de fumée (particules solides mais légères) placée
sur le radiateur.
Le transfert d'énergie thermique se fait par convection, avec transfert de matière.
III - TRANSFERT D’ENERGIE PAR RAYONNEMENT
La température d'un objet laissé en plein soleil augmente : l'objet reçoit donc de l'énergie.
IV – PUISSANCE D’UN TRANSFERT THERMIQUE

- 3/5 -
V - VARIATION DE L’ENERGIE INTERNE ENTRE DEUX ETATS
1°) Expression de la variation de l'énergie interne d’un système sans
changement d'état
la capacité thermique C est donc égale à l'énergie qu'il faut apporter au système pour augmenter sa
température de 1 °C ou de 1 K. Elle peut être considérée comme constante lorsque la variation de
température se limite à un domaine restreint.
Application :
la capacité thermique massique de l’eau liquide est ceau = 4,18 kJ.°C-1.kg-1,
la capacité thermique massique de l'aluminium à cAl = 902 J.°C-1.kg-1
1. Calculer la variation d'énergie interne de :
a. meau = 200 g d'eau liquide dont la température passe de 20 °C à 80 °C
b. meau = 600 g d'eau liquide dans lequel se trouve un morceau d'aluminium de mAl = 250 g, quand la
température de l'ensemble passe de 60 °C à 10 °C
2. Ces variations de température étant obtenues par transfert thermique, interpréter le signe des
variations d'énergie.

- 4/5 -
2°) Expression de la variation de l'énergie interne avec changement
d'état d’un corps pur
A pression donnée, le changement d'état d'un corps pur s'effectue à température constante.
L correspond au transfert thermique nécessaire pour
faire changer d'état l'unité de masse de cette substance.
Pour une substance donnée, à chaque changement
d’état correspond une chaleur latente.
La vaporisation, la fusion et la sublimation nécessite
un transfert d'énergie de l'extérieur vers le
corps :
subfusvap L,L,L
, sont positives
en revanche, la solidification, la condensation et la
liquéfaction s'accompagne d'un transfert d'énergie du
corps vers l'extérieur :
liqcondsol L,L,L
sont négatives.
Entre ces chaleurs latentes existe les relations
suivantes :
vapliqsubcondfussol LL;LL;LL
Application :
Pour l'eau,
1
fus kg.kJ334L
1. Un cube de 25 g de glace se trouve initialement à la température de 0,0 °C. On le place dans un verre
en contact avec l'atmosphère à 20 °C. Calculer sa variation d'énergie interne lors de la fusion, l'eau de
fonte étant à 0 °C. Commenter le signe du résultat.
2. Un seau contient 5,4 kg d'eau à l'état liquide, à la température de 0 °C. La température de l'extérieur
est égale à -5 °C. Calculer la variation d'énergie interne de l'eau quand elle est totalement transformée
en glace à 0 °C. Commenter le signe du résultat.

- 5/5 -
VI – PRINCIPE DE CONSERVATION DE L’ENERGIE
Si l'énergie d'un système augmente, c'est qu'il reçoit de l'énergie de l'extérieur. Si son énergie diminue,
c'est qu'il cède de l'énergie à l'extérieur. Le transfert d'énergie avec l'extérieur peut se faire par le travail
des forces extérieures agissant sur le système, par transfert thermique ou bien par rayonnement.
En apportant de l'énergie à un système, on augmente la valeur de son énergie. Cette énergie stockée peut
par la suite être restituée à l'extérieur.
Application :
On considère des panneaux d'une surface totale de valeur S égale à 16 m², utilisés pour le chauffage
domestique.
Les conditions d'ensoleillement sont telles que la puissance du rayonnement par unité de surface PS est
égale à 500 W.m-2.
Tout le rayonnement reçu est supposé être absorbé par les panneaux et le transfert thermique avec
l'extérieur est négligeable.
1. Quelle est la puissance du rayonnement solaire absorbé par les panneaux ?
2. Quel est l'énergie Wray reçue en 1h ?
3. Quelle masse d'eau peut-on chauffer de 20 °C à 50 °C avec ce dispositif ? la capacité thermique
massique de l'eau est
11 kg.C.kJ2,4c
1
/
5
100%