SIDA et défenses immunitaires

SIDA ET DEFENSES IMMUNITAIRES
Le système immunitaire est capable de détecter des ¢ ou des molécules étrangères à l’individu. Il est
capable de distinguer les ¢ et les molécules de l’individu, et de savoir si des ¢ sont étrangères ou
devenues étrangères (infectées par un virus, cancéreuses)
MALADIE QUI TOUCHE LE SYSEME IMMUNITAIRE, LE SIDA
I - L’agent responsable du SIDA
- agent responsable du SIDA : VIH
- 2 types différents de VIH : VIH1 et VIH2
- virus à ARN : génome contenu dans 2 molécules d’ARN enfermées dans une coque protéique
(capside)
- rétrovirus, c-à-d qui transcrit inversement l’ARN viral par action de la transcriptase inverse
(rétrotranscription) obtention d’un ADN viral qui s’intègre au génome de l’hôte (pro-virus)
- virus entouré d’une enveloppe phospho-lipidique contenant des protéines GP120 fixation du virus
sur la ¢ hôte, liaisons avec des protéines membranaires de la ¢ cible : les récepteurs CD4
- récepteur CD4 spécifique aux ¢ cibles du VIH
- liaison GP120 – CD4 fusion de l’enveloppe virale et de la membrane cellulaire, injection des 2
molécules d’ARN et des protéines enzymatiques virales (intégrase, transcriptase inverse, protéase)
- ¢ cibles du VIH : principalement des ¢ immunitaires (LT4, macrophages), présentes en grande quantité
dans les ganglions lymphatiques où elles jouent un rôle de réservoir de VIH quand elles sont infectées
II - Les modes de contamination
A. Par voie sexuelle
- VIH présent dans les sécrétions sexuelles transmission lors de rapports sexuels
- transmission facilitée lors de rapports avec de nombreux partenaires et non protégés
- seul moyen de protection : le préservatif
B. Par voie sanguine
- risque de transmission élevé lors de l’échange de seringues chez les toxicomanes et lors des
transfusions
- risque de contamination lors d’une transfusion sanguine toutefois très faible : 1 / 500.000
C. Par voie materno-fœtale
- passage de la barrière hémato-placentaire par le VIH
- cas les plus fréquents : transmission lors de l’accouchement, ou par l’allaitement (surtout en Afrique)
- risque plus élevé pour le VIH1 (15 – 20%) que pour le VIH2 (5%), chiffre qui grimpe si allaitement,
qui diminue si traitement préventif
III - La primo-infection
symptômes d’une infection virale bénigne : fièvre, gonflement des ganglions lymphatiques, courbatures
A. Les 1ères semaines
- augmentation de la charge virale (nombre de molécules d’ARN viral circulant dans le sang / mL de
plasma sanguin division par 2 pour avoir le nombre de VIH)
- forte diminution du nombre de LT4 multiplication très active du virus
- pas encore de réponse immunitaire

B. Après 2 à 12 semaines
- période très variable selon les individus
- mise en place de la réponse immunitaire
- fabrication d’Ac anti-VIH, production de LT cytotoxiques qui tuent les LT4 infectés diminution de
la charge virale
- établissement d’un équilibre entre production de nouveaux virus et destruction de ceux-ci début de
la phase asymptomatique
IV - La phase asymptomatique
A. Les caractéristiques
- durée moyenne de 10 ans, mais très variable selon les individus : de 2 à 15 ans
- pas de symptômes pendant cette période, la personne se porte bien
- défenses immunitaires actives, production d’Ac, défense contre le VIH : LT cytotoxiques dirigés
contre les ¢ infectées par le VIH, sous le contrôle des LT4 non infectés
- diminution progressive du taux de LT4, multiplication du virus
- fabrication d’Ac pas immédiate : fenêtre sérologique de 2 à 12 semaines après laquelle la personne est
séropositive pour le VIH
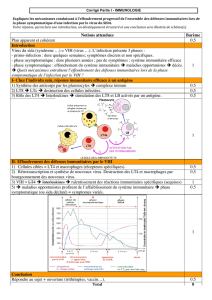
B. Le dépistage
- test ELISA : détection d’Ac anti-VIH, peu fiable pendant les 12 premières semaines puisque
l’organisme ne fabrique pas d’Ac dès la contamination mais après un certain temps
- test Western Blot : migration de différentes protéines propres au VIH sur une bandelette, plus fiable,
mais plus coûteux et plus compliqué à réaliser, utilisé pour vérifier un test ELISA douteux
- pas de test chez le nouveau né : présence des Ac maternels, donc possibilité d’avoir un séropositif
négatif attendre quelques mois, le temps qu’il ait éliminé les Ac maternels et qu’il fabrique les siens
V - La maladie SIDA : phase symptomatique
- effondrement du nombre de LT4
- arrêt de la production de ¢ cytotoxiques et d’Ac
- forte augmentation de la charge virale, puis baisse lorsqu’il n’y a plus de LT4 à infecter, sans atteindre
0 : les derniers virus dans le sang y reste puisqu’il n’y a plus d’Ac pour les détruire
- destruction totale du système immunitaire acquis développement de maladies opportunistes :
cancers, infections, parasites mort de l’individu
- traitements : antirétroviraux essayer de réagir à divers niveaux du mécanisme d’infection :
empêcher la rentrée des virus, bloquer l’intégrase ou la protéase, … ne pas permettre l’intégration de
l’ARN viral
- énormes mutations du virus pas de vaccin
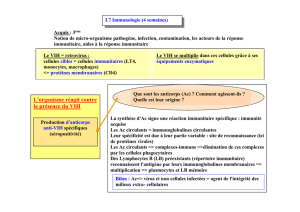
Après l’infection par le VIH, il y a :
- production d’anticorps spécifiques au VIH par des LB (plasmocytes) qui neutralisent le VIH
- production de LT cytotoxiques qui tuent les ¢ infectées
Le SIDA correspond à une déficience du système immunitaire causée par la destruction des - LT4 qui
d’ordinaire stimulent les LT cytotoxiques et les LB.

LES PROCESSUS IMMUNITAIRES
I - Les anticorps : agents du maintien de l’intégrité du milieu extracellulaire
Les personnes séropositives fabriquent des anticorps spécifiques dirigés contre certaines protéines du
virus.
A. Structure d’un anticorps
- anticorps : protéines de la famille des immunoglobulines, dont les immunoglobulines G (IgG)
B. Rôle des anticorps dans la réaction immunitaire
- non-soi neutralisé par la formation des complexes Ag – Ac, appelés complexes immuns
agglutination quand Ag particulaire, précipitation quand Ag soluble
- élimination des complexes immuns intervention des défenses immunitaires innées : phagocytose
- macrophages et granulocytes : récepteurs membranaires spécifiques des fragments constants des Ig
fixation des Ig aux membranes des phagocytes neutralisation et élimination des virus, comme le VIH
avant qu’il ne rentre dans une ¢
- technique d’identification des Ag ou des Ac produits ou présents dans le corps : Ouchtercony
C. Déclenchement de la production des anticorps plasmatiques
Les Ag plasmatiques sont produits par des plasmocytes, ou LB sécréteurs. Ce sont des ¢ qui proviennent
de la différenciation des LB et qui restent dans les ganglions lymphatiques
1) Reconnaissance de l’antigène : la sélection clonale
- de très nombreux types de LB dans l’organisme, distinction uniquement par leurs récepteurs B
(récepteurs à un Ag donné)
- récepteurs B : Ig enchâssés dans la membrane des LB et qui possèdent la même partie variable que les
Ac produits ensuite
- préexistence de tous les LB avant un contact avec l’Ag
- reconnaissance et fixation d’un Ag sélection des LB qui lui sont spécifiques
- idem pour certains LT4 spécifiques du même Ag
sélection clonale
2) Réponse à l’identification de l’antigène
- LB ayant reconnu l’Ag dont ils sont spécifiques stimulation des LT4 sélectionnés, spécifiques du
même Ag
- multiplication des LT4 et différenciation en LT4 auxiliaires (ou Helper)
- LT4 auxiliaires : production d’un messager chimique non spécifique : interleukine (IL), qui stimule les
LB sélectionnés et seulement ceux-là réaction immunitaire : multiplication des LB sélectionnés et
activés
- fragment constant commun à tous les IgG
de tous les humains
- fragment variable différent selon les IgG,
complémentaire d’un Ag précis
- 4 fragments variables par Ac 2 sites de
fixation pour les Ag
- action des Ac reposant sur la relation
entre site de fixation et Ag
- partie basse du fragment constant reconnu
par les ¢ de l’immunité innée
élimination des complexes immuns
- partie variable : généralement reconnaissance de fragments protéiques

- formation d’un clone de nombreux LB qui ont la même spécificité que le LB qui a reconnu l’Ag :
expansion ou prolifération clonale fabrication de 2 types de ¢ :
∟ LB effecteurs : plasmocytes fabricant de très nombreux Ac spécifiques de l’Ag pour le
neutraliser
∟ LB mémoires : LB qui répondront plus rapidement et plus efficacement lors d’une rencontre
ultérieure avec le même Ag
- LB mémoires : plus de récepteurs B à leur surface que les LB vierges, durée de vie beaucoup plus
longue (30 à 40 ans), plus nombreux (en moyenne 100.000 contre 1.000)
Les Ac sont des effecteurs de l’immunité acquise. Ils agissent dans le milieu extracellulaire en se fixant
aux Ag qui ont déclenché leur formation. La synthèse des Ac est donc la réaction de l’organisme à la
présence d’éléments étrangers. Dans le cas du SIDA, cela ne permet de neutraliser que les Ag circulant,
et pas ceux dans les ¢. Ce rôle est assuré par les LT8.
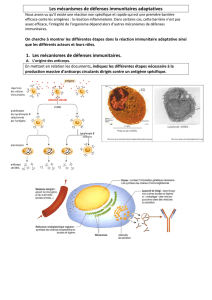
II - Les LT cytotoxiques : agents du maintien de l’intégrité des populations cellulaires
A. Identification de l’antigène
- possession par le corps de clones de LT8 qui se distinguent par leur récepteur T spécifique d’un Ag
donné préalablement à tout contact avec l’Ag
- LT8 : maturation dans le thymus
- récepteurs T un peu différents des récepteurs B : 2 chaînes polypeptidiques et un seul site de fixation
B. Mode d’action des lymphocytes T cytotoxiques
- fixation des LTc sur les ¢ présentant l’Ag dont elles ont des récepteurs spécifiques
- premier mode d’action possible : libération de perforines perforation de la membrane de la ¢ lyse
de la ¢ par entrée massive d’eau puis éclatement
- deuxième mode d’action possible : fixation d’interleukines sur la ¢ activation des gènes qui
conduisent à l’apoptose mort programmée de la ¢, « suicide cellulaire » par recloisonnement de la
membrane cytoplasmique et destruction du noyau
- débris de la ¢ lysée phagocytés par des macrophages ou des granulocytes
- coopération entre système immunitaire acquis et système immunitaire inné
C. Cas du SIDA
- reconnaissance de la protéine GP120 présentée par les ¢ infectées par les LT4 et les LTc destruction
des ¢ infectées
- récepteurs spécifiques de l’Ag repérer des ¢ infectées
par un pathogène, qui présentent systématiquement à leur
surface des fragments polypeptidiques issus des protéines
du pathogène que les ¢ non infectées ne présentent jamais
- sélection clonale des LT8
- prolifération des LT8 et différenciation en LTc sous la
dépendance des LT4 (cf. schéma précédent)
- LT8 capables de reconnaître les ¢ cancéreuses et les ¢
contaminées par un virus
- sélection dans le thymus pour éliminer les LT4 et les
LT8 qui reconnaîtraient des molécules du soi comme étant antigéniques

- protéine GP120 présente à la surface de la ¢ seulement après transcription et traduction de l’ADN
viral : pas de destruction des ¢ où le VIH est inactif, sous forme de provirus car pas de GP120 produit
réservoir de virus
- action des LT8 uniquement sur des ¢ et pas sur des Ag solubles : immunité qui utilise les LTc
complétée par l’immunité qui produit des Ac
III - La vaccination et la mémoire immunitaire
A. Principe
- but : rendre le système immunitaire plus efficace lors de la rencontre avec un pathogène
- modes d’action :
∟ renforcement de la production d’Ac (vaccin contre la grippe, la rubéole, la rougeole, …)
∟ stimulation de la production de LTc (vaccin Sabin contre la poliomyélite)
- 1ère rencontre avec l’Ag production lente d’Ac : réponse primaire, avec production de LBm et LTm
(durée de vie plus longue, plus de récepteurs, plus nombreux)
- 2ème rencontre avec l’Ag réponse plus rapide et de plus grande amplitude : réponse secondaire qui
met en jeu les Lm, plus nombreux, avec plus de récepteurs, et qui ont subi un début de différenciation
par l’interleukine lors de la réponse primaire
- principe de la vaccination : mimer une réponse primaire en provocant un faux premier contact avec
l’Ag
- but : permettre à l’organisme de fabriquer des LTm et des LBm capables d’intervenir rapidement lors
d’une vraie rencontre avec l’Ag
- généralement, injection de virus / bactéries inactivés, atténués, ou de protéines virales reconnues
comme antigéniques
- protection naturelle toujours plus efficace que la vaccination
- technique curative : la sérothérapie injection d’Ac, très efficace à très court terme
B. Cas du vaccin anti VIH
- VIH : virus très efficace
- technique de pénétration dans la ¢ très élaborée
- transmission possible de ¢ à ¢
- passage d’un LT4 à un autre sans rester longtemps dans le liquide extracellulaire au niveau des
ganglions
- mutation très fréquente car rétrotransciption peu fidèle réalisation d’un vaccin qui reconnaîtrait tous
les VIH très difficile
- VIH capable de se cacher dans le cerveau, très peu accessible par les L
C. Interaction environnement – génotype
- phénotype immunitaire : ensemble des spécificités des LB et des LT à un moment donné de la vie de
l’individu répertoire des récepteurs B et T
- des milliards d’Ag, mais pas des milliards de gènes qui correspondraient à des milliards de récepteurs
spécifiques aux Ag existence de mécanismes génétiques particuliers qui permettent la fabrication de
récepteurs différents très nombreux
- existence de spécificités dirigées contre le soi dans le répertoire, éliminées dès leur production
- si non éliminées maladies auto-immunes provoquées par des ¢ auto réactives
Le phénotype immunitaire d’un individu varie au cours de sa vie en fonction de son environnement
antigénique : il s’adapte. Il existe des défenses innées et des défenses acquises, et ces 2 systèmes
coopèrent. Dans le système acquis, il y a une production d’Ac contre les Ag circulants par les LB, et une
production de LTc contre les ¢ du non-soi. Le SIDA inactive les défenses immunitaires en s’attaquant
aux LT4 car les mécanismes de l’immunité acquise sont en très grande majorité sous le contrôle des
LT4.
1
/
5
100%