PCSI-PSI AUX ULIS

PCSI
T0 : VOCABULAIRE UTILE EN THERMODYNAMIQUE
à connaître en physique et en chimie
Objet de la Thermodynamique : décrire les échanges de matière et d’énergie entre un système
et le milieu extérieur .
. SYSTEME THERMODYNAMIQUE .
1. Définition :
Système matériel , délimité dans l’espace par une frontière , réelle ou virtuelle.
Pour définir précisément un système , il faut :
- en détailler le contenu ;
- spécifier si la frontière ( ou « enveloppe » ) en fait partie .
Tout ce qui n’est pas le système constitue le « milieu extérieur » .
L’ensemble { système , milieu extérieur } forme « l’Univers » .
2. Transferts entre le système et l’extérieur :
a. Différents types de transfert :
Transfert de matière ; « transfert thermique » ou « chaleur » Q ,
Transfert d’énergie , sous forme de « travail » W ( mécanique ou électrique ) .
b. Distinction de systèmes :
Système « ouvert » « fermé » « isolé »
Remarques :
Un système isolé est nécessairement fermé , mais la réciproque n’est pas vraie ( ex : réaction
Un système peut être seulement : chimique exo- ou endothermique ) .
- « isolé thermiquement » : pas d’échange de chaleur avec l’extérieur ;
Les transformations subies par un tel système sont alors dites « adiabatiques » ( parois dites
- « isolé mécaniquement » : pas d’échange de travail avec l’extérieur . « athermanes » ) .
c. Conventions de signes :
Ce qui est reçu par le système est compté positivement ; ex : réact. chim. endothermique
Q r
0 .
Ce qui est cédé par le système est compté négativement . réact. chim. exothermique
Q r
0 .
Transferts
avec
l’extérieur
matière
possibles
énergie
matière impossible
énergie possible
matière
impossibles
énergie
Exemples
- système { eau , air contenu
dans une cocotte - minute }
dont la soupape siffle .
- système { eau , air dans
cocotte - minute } dont la
soupape ne siffle pas .
- « Vase de Dewar » ;
- « Bouteille Thermos » fer-
mée et de bonne qualité .
Masse
totale
Varie
Ne varie pas : « conservation de la masse » .
Rq : Possibilité , au sein du système , de : transformation physique ,
ou
de réaction chimique : il y a alors , dans ce dernier cas ,
également
possibilité de variation du nombre de particules .
du nombre de particules .

. ETAT THERMODYNAMIQUE d’un SYSTEME .
1. Etude générale d’un système thermodynamique :
Particularité d’un système thermodynamique : le nombre très élevé des constituants élémentaires
qu’il contient .
Exemple : 1 mm 3 d’air ambiant contient 10 16 molécules ...
d’où une étude à 3 niveaux :
microscopique mésoscopique macroscopique
Impossibilité d’accéder à la Etude sur un volume d très L’état du système est défi-
connaissance de la position petit à l’échelle de nos instru- ni par la connaissance de
et de la vitesse de chaque ments de mesure , mais suffi- grandeurs mesurables ,
particule . On parle de : samment grand pour contenir telles que :
« chaos moléculaire » . assez de particules afin que - le volume V ,
les grandeurs thermodynami- - la température T ,
ques ( moyennées sur d
) - la pression P ...
aient un sens .
Ex :
dm
d
.
2. Etude macroscopique : définitions .
a. Grandeur d’état : toute grandeur macroscopique que l’on peut mesurer sur un système et
dont la donnée participe à la description de l’état du système .
Ex : volume V , pression P , température T , masse m , concentration c , etc ...
On dira d’une grandeur d’état qu’elle est :
« extensive » si elle est proportionnelle à la quantité de matière contenue dans un système
« intensive » si elle ne dépend pas de cette quantité de matière . homogène .
Ex :
Une grandeur physique X est dite extensive si, quand on associe la grandeur X1 à (S1) et la grandeur X2 à
(S2), on doit alors associer X1+X2 à (S1)(S2).
b. Variables - ou paramètres - d’état : grandeurs d’état indépendantes
dont le nombre est
nécessaire et suffisant pour décrire l’état macroscopique du système .
« indépendantes » aucune variable d’état ne peut être déterminée à partir des seules autres variables d’
état grâce à une relation expérimentale ou relative à un modèle .
c. Fonctions d’état : grandeurs d’état qui ne sont pas les variables d’état , mais qui s’en dédui-
sent par une « équation d’état » (
relation entre les variables d’état ) .
Exemple du gaz parfait :
Equation d’état : PV nRT PVm RT , avec Vm
V
n
( volume molaire ) .
Grandeurs d’état : P , V , Vm , n , T .
Variables d’état : P , Vm T fonction d’état : T PVm / R ;
ou P , T Vm fonction d’état : Vm RT / P ;
ou Vm , T P fonction d’état : P RT / Vm .
3. Equilibre thermodynamique .
Un système est en équibre thermodynamique si toutes ses variables d’état demeurent uniformes
(espace) et stationnaires (temps), en l’absence de tout transfert avec l’extérieur , ce qui implique les
équilibres thermique , mécanique et chimique ( c’est-à-dire respectivement : T , P et composition , uniformes et
constantes).
V , m , n , q
P , T , , c
V , m , n , q
P , T , , c
on enlève
la paroi
2V, 2m, 2n, 2q extensives
P , T , , c intensives

. TRANSFORMATIONS THERMODYNAMIQUES .
1. Définition : le système subit une transformation s’il passe d’un état A à un état B ,
avec ou sans transfert avec l’extérieur .
On distingue :
Transformation « élémentaire » ( ou « infinitésimale » ) :
les valeurs finales des variables d’état sont infiniment proches des valeurs initiales .
Transformation « finie » entre 2 états d’équilibre A et B :
résultat d’une suite continue de transformations élémentaires .
On distingue également ( en chimie ) :
Transformation chimique : s’accompagne d’un changement d’espèces chimiques .
Ex : 2 H 2 O 2 2 H 2 O .
Transformation physique : n’implique que des changements de phase .
Ex : CO2 s CO2 g .
Transformation physicochimique : transformation physique et / ou chimique .
2. Quelques transformations particulières entre 2 états d’équilibres A et B :
a. quasistatique : suite continue d’états d’équilibre interne du système .
limite idéale ( théorique ) de transformations continues très lentes , obtenues par des modifica-
tions infiniment petites des contraintes appliquées au système .
le milieu extérieur peut ne pas être en équilibre avec le système .
b. réversible : transformation quasistatique , au cours de laquelle le milieu extérieur est à tout
instant en équilibre avec le système .
il y a alors « réversibilité du temps » : si la transformation est réalisée en sens inverse , le
système et le milieu extérieur repassent par les mêmes états d’équilibre .
une transformation réversible est toujours quasistatique .
c. irréversible : les états intermédiaires ne sont pas tous des états d’équilibre .
d. cyclique : l’état final F est le même que l’état initial
.
Tranformation Caractéristiques
monobare Pext uniforme et constante .
mais Psyst non définie ou non constante
au cours de la transformation .
isobare Pression P du système définie et constante à tout instant .
monotherme Text uniforme et constante ( mise en contact du système avec une
source de chaleur – ou « thermostat » ) .
isotherme Température T du système définie et constante à tout instant .
isochore Le volume V du système reste constant à tout instant .
Le système n’échange n’effectue aucun transfert thermique avec
adiabatique Causes : l’extérieur .
- le système est isolé thermiquement ;
ou - la transformation est beaucoup plus rapide que les échanges de chaleur .

. NOTION de PHASE .
1. Définition : Une phase est une région de l’espace dans laquelle toutes les grandeurs d’état
intensives X ( x , y , z ) sont des fonctions continues des coordonnées de l’espace .
2. Exemples de systèmes monophasiques :
- mélange de gaz phase gazeuse .
- liquides miscibles phase liquide . ex : (eau , alcool )
- solutions solides phase solide . ex : alliage or - cuivre .
3. Exemples de systèmes polyphasiques :
Ex : mélange de 2 liquides non miscibles . ex : eau - éther , eau - huile , ...
corps pur diphasé . ex : eau liquide en présence de vapeur d’eau .
4. Phase « uniforme » :
Une phase est dite « uniforme » lorsque toutes les grandeurs d’état intensives ont des valeurs
indépendantes des coordonnées de l’espace .
Ex : l’air d’une pièce , si on considère en 1ère approximation :
- la pression uniforme ( car très faible variation d’altitude ) ,
- la température uniforme .
Contre-ex :
l’atmosphère terrestre : différents modèles selon certaines « tranches » d’altitude .
- modèle de l’atmosphère isotherme : T uniforme , P ( z ) continue mais décroissante ;
- modèle de l’atmosphère à gradient de température :
T ( z ) continue mais décroissante , il en est de même pour P( z ) .
Dans les 2 cas , l’atmosphère , phase gazeuse , n’est pas uniforme , car au moins une
des grandeurs d’état varie d’un point à un autre .
5. Notion de système physicochimique .
Espèce chimique : toute entité représentée par une formule chimique définie .
ex : O 2 , CO 2 , H 2 O , ....
Espèce physicochimique : espèce donnée dans une phase donnée .
ex : H 2 O s ( solide )
H 2 O l ( liquide ) 3 espèces physicochimiques pour
H 2 O g ( gaz ) une même espèce chimique .
Un système physicochimique est déterminé par la liste et la quantité des différentes
espèces physicochimiques qu’il contient .
------------------------------

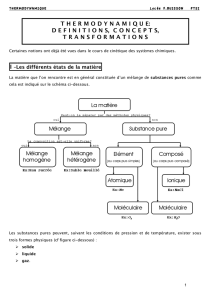
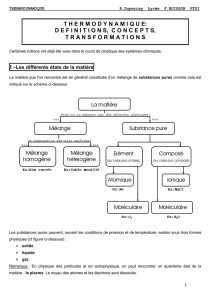
ANNEXE 1 – Les différents états de la matière
La matière que l’on rencontre est en général constituée d’un mélange de substances pures
comme cela est indiqué sur le schéma ci-dessous.
Les substances pures peuvent, suivant les conditions de pression et de température, exister
sous trois formes physiques (cf figure ci-dessous) :
solide
liquide
gaz.
Remarque : En physique des particules et en astrophysique, on peut rencontrer un quatrième
état de la matière : le plasma. Le noyau des atomes et les électrons sont dissociés.
L’état solide
Il s’agit d’un état compact dont les éléments constitutifs (des atomes métalliques ou non, des
ions, des molécules) sont distribués de façon régulière dans l’espace selon une géométrie
tridimensionnelle périodique que l’on appelle un cristal (voir cours de chimie sur l’architecture de
la matière). Il s’agit d’un état de la matière ordonné.
Remarque : Il existe des solides amorphes (le verre par exemple) à mi-chemin entre un solide et
un liquide extrêmement visqueux. Les éléments constitutifs ne sont pas ordonnés dans l’espace.
Pour un solide, on a aussi les caractéristiques suivantes:
 6
6
 7
7
 8
8
1
/
8
100%