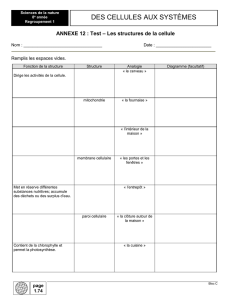
Chapitre 2 : Les Méthodes d`analyse de la Cellule

1
Chapitre 2 : Les Méthodes d’analyse de la Cellule – Bernard Rousset
Sommaire
PARTIE 1 : Approches et Moyens d’études de la Cellule – Page 1
PARTIE 2 : Méthodes d’analyse de la forme et de la structure des cellules et des organites – Page 10
PARTIE 3 : Méthodes d’études des constituants moléculaires de la cellule - Page 18
PARTIE 4 : Quelques méthodes d’études du fonctionnement cellulaire – Page 21
PARTIE 1 : Approches et Moyens d’études de la Cellule
I – Source de matériel biologique et utilisations principales.
A) Organes-Fragments d’organe (Tissus)
Source
Animaux d’abattoirs
Animaux de laboratoire
Homme
Législation
Aucune
- Loi d’agrément des
locaux.
- Personnel formé.
- Loi Hurriet
- Comité d’éthique
- CPP
Accessibilité
Facile
- Selon disponibilité
- Travail de Diagnostic
- Opération pour tissus
anormaux.
Temps de Recueil
Court
Court
Long
B) Lignée Cellulaire
- Lorsque l’on veut travailler sur des lignées cellulaires, on utilise des cellules immortalisées càd des
cellules capables de se multiplier de manière infinie.
1 - D’où proviennent ces cellules ?
- Elles sont soit issues de Tumeurs soit elles résultent de modifications génétiques expérimentales.
Fascicule.
2 – Conservation de ces lignées
- La conservation par congélation est la technique la plus répandue. Cependant, il existe différentes
conditions de conservation qui ne dépendent que des buts poursuivis (ce que l’on veut faire de ce
matériel biologique) qui peuvent être la viabilité, le maintien de la structure ou le stockage simple du
matériel biologique.
II – Modalités de Conservation du matériel biologique
- La technique de préservation des structures et des constituants cellulaires est la Congélation.
Cependant, selon l’usage que l’on veut faire a posteriori de ces échantillons, ces derniers ne doivent
pas être conservés dans les mêmes conditions. Il existe donc plusieurs techniques de congélation :

2
Conditions Standards
A très basse température
Congélation par
Cryoprotection
- 20 à – 80°C
-100°C
- Technique avec ajout de
Glycérol et DMSO
- Diminution progressive de la
température.
- Stockage entre -80°C / -196°C
- L’eau passe de l’état liquide à
l’état vitreux.
Lyse cellulaire (= Destruction
des structures cellulaire mais
conservation du contenu.)
Mort Cellulaire (=Conservation
des Structures.)
Survie de la Cellule
III – Modalités de Fixation des cellules et tissues pour examen morphologique
- La Fixation, c’est le traitement qui sert à établir des ponts chimiques entre certaines
macromolécules afin de figer des structures cellulaires dans un certain état.
A) Composés utilisés
- Aldhéyde : C’est une fonction chimique qui correspond à l’oxydation d’un alcool primaire.
Pour fixer des tissus animaux, on utilise du Formaldéhyde ou du Glutaraldéhyde.
B) Réactions
- Les réactions qui s’enchainent se font avec les fonctions amines primaires.
Fascicule.
IV – Utilisation principales du matériel biologique
Lorsque l’on veut travailler sur un échantillon viable, il faut :
- Connaitre Le nombre de cellule viables dans l’échantillon (Test du Bleu de Tryptophane)
- Séparer et trier les différentes cellules en présence pour se concentrer sur un seul type de cellules.
A) Numération par comptage cellulaire
- Lames de Verre qui présentent des rayures sur sa partie centrale permettant d’obtenir des volumes
définies. (Lame Thomas ou Malasse )
- On dispose dans ces rayures un goutte cellulaire (fraction aliquote : 20µl sur 5ml)
- On place au-dessus de la lame, une lamelle qui piège une certaine hauteur de liquide fixe que l’on
connait.
- On peut compter le nombre de cellules présentes dans un champs microscopique (=Volume) connu.
B) Numération par quantification d’ADN
- On va compter les cellules en faisant une mesure de l’ADN. En effet, au sein d’un organisme connu,
toutes les cellules on la même quantité d’ADN par noyau.
Chez l’Homme, un noyau contient 8 pg d’ADN
- Dans une fraction aliquote, on connait la quantité d’ADN et donc la quantité cellulaire présente.

3
V – La culture des cellules : Primaire & Secondaire
- Culture primaire : Culture de cellules fraichement isolées.
- On fait de manière fréquente des cultures de cellules adhérentes au support.
A) Conditions d’ensemencement
1 – Dans les flacons traités pour la culture cellulaire
- Boite de Pétri : 3 à 30 cm de Diamètre
- Flacon : 25 à 500 ml
- Plaques multi-puits : < 30 ml ; Culture d’une seule cellule par puit.
2 – Dans un milieu complexe
- Il existe de nombreuses sortes de milieux complexes différentes les uns des autres. Cependant, tous
contiennent :
- des éléments essentiels à la synthèse des constituants et au métabolisme (ions glucose,
acides-aminés, vitamines...) Il s’agit de tout ce que n’apporte plus la cellule.
- Sérum : Sérum de Veau Fœtal en Général (= SVF) dont le pourcentage, par rapport au milieu
est de 0,5 à 10 %. Le SVF est un Facteur :
- D’adhésion
- De croissance
- D’Hétérogénéité.
- D’antibiotiques : nécessaires pour la culture de cellules eucaryotes pour empêcher la
prolifération de cellules procaryotes (=Bactéries.)
3 – Densité d’ensemencement
La densité d’ensemencement est variable suivant les buts suivis de la création d’une lignée cellulaire.
Cette densité d’ensemencement varie entre 104 et 106.
4 – Volume d’ensemencement
- Le Volume d’ensemencement est également variable. On essaye toutefois de laisser un mince film
de 2 à 3 mm pour favoriser les échanges gazeux. En effet, les cellules présentent des besoins en
apport d’Oxygène et de rejet de CO2..
B) Conditions de culture
- La culture cellulaire est maintenue dans un incubateur. Il s’agit d’un flacon jamais fermé présentant,
pour la survie de la lignée, les caractéristiques suivantes :
- L’atmosphère est constituée d’un mélange de 95% d’air et de 5% de CO2. Celui-ci contrôle
le pH. En effet, il est nécessaire pour cultiver des cellules que l’on travaille dans un milieu tamponné
(milieu où le pH est contrôlé par un système tampon.)
- La température est réglée à 37°C (Température physiologique de l’organisme humain.)
- Le milieu dans lequel on travaille, est un milieu stérile afin d protéger non seulement le
milieu, mais également l’expérimentateur.

4
C) Devenir des cellules
1 – Adhérence au support
- Dure de quelques heures à 24H.
- L’adhérence est la capacité d’une cellule à se fixer au support, càd de s’adapter au milieu dans
lequel elle va effectuer sa culture.
2 – Evolution des cellules dans les boites de culture.
2.1 – Les cellules ne se multiplient pas
- Si l’ensemencement est à forte densité, on doit obtenir une couche cellulaire continue.
- Si l’ensemencement est à faible densité, on doit obtenir des îlots de cellules (cellules isolées ou en
petits groupes.)
2.2 – Les cellules se multiplient
- Si on a un ensemencement à faible densité et que les cellules se multiplient, on observe une
division cellulaire. Celle-ci s’achève quand il n’y a plus de possibilités de se multiplier (milieu trop
étroit.) A ce moment précis, on dit que les cellules sont arrivées à confluence.
- Suite à ce moment de confluence, on traite légèrement les cellules avec un enzyme protéolytique (=
capable de scinder une protéine – La Trypsine par exemple.)
- Nous avons donc créer une culture secondaire.
D) Devenir des cellules en culture
- La vitesse de multiplication d’une lignée cellulaire est caractérisée par son Temps de Doublement
de Population (TDP)
E) Expression de la différenciation
- Chaque cellule est spécifique est cette spécificité se manifeste lors de la création de lignée
cellulaire, par l’apparition de caractéristiques fonctionnelles conservées par les cellules. Il s’agit de la
réacquisition (= les cellules retrouvent les caractéristiques morphologiques et les propriétés
fonctionnelles qui les caractérisent.)
Exemple de spécificités réacquises :
- Neurones = Formation d’extensions
- Cellules cardiaques = Fréquences de Battements.
- Cellules épithéliales = Réorganisation Tridimensionnelle.
VI – Etablissement de lignées cellulaire : Le Clonage et la Fusion Cellulaire.
Le Clonage : qu’est-ce que c’est
C’est l’obtention d’une population à partir de la multiplication d’une seule cellule.
Comment l’obtient-on ?
On prend une culture de cellule en suspension que l’on dilue pour avoir une cellule par puit de culture.
On cultive cette cellule jusqu’à obtenir un clone puis une lignée cellulaire clonales. On peut par la suite
faire un stockage de cette lignée clonée par congélation.

5
A) Etablissement de lignées cellulaires
- Deux possibilités
1 – A partir de cellules normales
- Les cellules dites « normales » sont des cellules incapables de se multiplier spontanément. Il leur
faudra donc acquérir cette caractéristique de multiplication infinie que l’on nomme ’immortalisation
des cellules.
- On donne cette capacité aux cellules (l’immortalisation) en introduisant dans ces cellules, un ou
plusieurs gènes exogènes qui transforment ces cellules. Celles-ci vont donc pouvoir se multiplier de
manière infinie.
- On introduit ce gène dans une cellule hôte à l’aide d’un vecteur plasmidique (issu de bactérie) ou
vecteur viral (issu d’un virus.)
Attention vocabulaire ! On transfecte un gène vers une cellule eucaryote mais on transforme un
gène vers une cellule procaryote.
Lorsque le gène s’exprime au sein d’une cellule, on obtient des plages de cellules qui se multiplient.
Cependant, l’affectation d’un gène dans le caryotype d’une cellule peut présenter des inconvénients.
En effet, on ne sait jamais si ce gène va être intégrer ou non par la cellule. C’est pourquoi on
transfecte certains gènes uniquement dans des lignées dont on connait les diverse caractéristiques.
2 – A partir de cellules tumorales (animales ou humaines)
- Pour créer une lignée cellulaire clonale à partir de cellules tumorales, il suffit de mettre directement
ces cellules en culture et on obtiendra des plages où ces cellules se multiplient.
- On constate ici que la caractéristique de multiplication infinie est définie initialement dans les
cellules tumorales.
B) Culture des lignées cellulaires
- La culture de lignée cellulaire présente les mêmes caractéristiques que la culture de lignées
cellulaire clonales.
- On essaye d’identifier la subculture d’un lignée cellulaire (=le nombre de passages subis par les
cellules depuis la création de la lignée en question, que ce soit des cultures primaires ou secondaire.)
- Même si des conditions générales existent pour la création de lignées cellulaires, chaque type de
lignée cellulaire peut nécessiter des requis particuliers (proportion de Sérum…)
- Une culture effectuée dans un milieu chimiquement défini ne requiert pas de Sérum !
C) Autre modalités de culture (pour que les cellules puissent adhérer.)
1 - Culture de cellules sur plastique traité
2 – Culture de cellules sur Matrice extracellulaire
L’environnement péri-cellulaire est constitué de Collagène et d’autre protéines.
3 – Culture de cellules sur Micro-Porteur
Ce procédé est utilisé si on requiert une grande quantité de cellules.
4 – Culture de cellule en suspension
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%