Recepteurs passifs

Série de sciences physiques 2ème année Sciences
1 http://cherchari.ifrance.com/
Récepteurs passifs et loi d’Ohm – Modèle atomique
I- Essentiel à retenir :
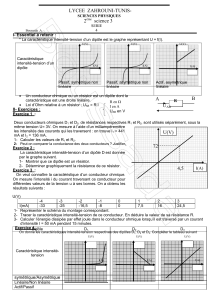
* La caractéristique intensité-tension d’un dipôle est le graphe représentant U = f(I).
Caractéristique
intensité-tension d’un
dipôle
Passif, symétrique non
linéaire
Passif, asymétrique non
linéaire
Actif, asymétrique
linéaire
Un conducteur ohmique ou un résistor est un dipôle dont la
caractéristique est une droite linéaire.
Loi d’Ohm relative à un résistor : UAB = R.I
II- Exercices :
Exercice 1 :
Deux conducteurs ohmiques D1 et D2, de résistances respectives R1 et R2, sont utilisés séparément, sous la
même tension U= 3V. On mesure à l’aide d’un
milliampèremètre les intensités des courants qui les
traversent : on trouve I1 = 441 mA et I2 = 136 mA.
1- Calculer les valeurs de R1 et R2.
2- Peut on comparer la conductance des deux
conducteurs ? Justifier.
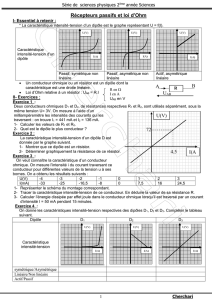
Exercice 2 :
La caractéristique intensité-tension d’un dipôle D est
donnée par le graphe suivant.
1- Montrer que ce dipôle est un résistor.
2- Déterminer graphiquement la résistance de ce résistor.
Exercice 3 :
On veut connaître la caractéristique d’un conducteur
ohmique. On mesure l’intensité i du courant traversant ce
conducteur pour différentes valeurs de la tension u à ses
bornes. On a obtenu les résultats suivants :
U(V)
-4
-3
-2
-1
0
1
2
3
I(mA)
-33
-25
-16,5
-8
0
7,5
16
24,5
1- Représenter le schéma du montage correspondant.
2- Tracer la caractéristique intensité-tension de ce conducteur. En déduire la valeur de sa résistance R.
3- Calculer l’énergie dissipée par effet joule dans le conducteur ohmique lorsqu’il est traversé par un courant
d’intensité I = 50 mA pendant 15 minutes.
Exercice 4 :
On donne les caractéristiques intensité-tension respectives des dipôles D1, D2 et D3. Compléter le tableau
suivant.
Dipôle
D1
D2
D3
Caractéristique intensité-
tension
symétrique/Asymétrique
Linéaire/Non linéaire
Actif/Passif
U(V)
I(A)
U(V)
I(A)
U(V)
I(A)
U(V)
I(A)
U(V)
I(A)
U(V)
I(A)
R
A
B
UAB
R en
I en A
UAB en V
U(V)
I(A
)
4,5
72

Série de sciences physiques 2ème année Sciences
2 http://cherchari.ifrance.com/
Chimie
Exercice 1 :
On donne les schémas de Lewis des quatre éléments chimiques suivants :
Les éléments A et C appartiennent à la 3ème période.
Les éléments B et D appartiennent à la 2ème période.
1. a- Donner la structure électronique des atomes correspondants à ces nucléides.
b- Déduire les numéros atomiques de ces éléments.
2. Deux de ces éléments appartiennent à la même famille ; lesquels ? Justifier la réponse.
3. L’élément A est le chlore ; son nombre de masse est égal à 35.
a- Donner la composition de son noyau.
b- Représenter son nucléide.
Donner la structure électronique de l’ion simple que donne l’atome de chlore. Quelle est la charge électrique
de cet ion ?
Exercice 2 :
On donne les atomes suivants : F(Z=9) ;O(Z=8) ;C(Z=6). Cl(Z=17)
1-Représenter la structure électronique de chaque atome.
2-Donner le schéma de Lewis correspondant à chacun d’eux.
3-Combien de liaisons covalentes peut établir chaque atome ?
4-Expliquer en utilisant les schémas de Lewis la formation des molécules suivantes :
HF ; CH 2Cl 2 ; C 2H 4Cl2.
Exercice 3 :
1- Déterminer pour chaque atome des éléments chimiques suivants :
- La charge du noyau – Le nombre d’électrons, le nombre de neutrons et la masse :
Cl
35
17
O
16
8
et
Fe
56
26
On donne e = 1,6.10-19 C et mp = mn = 1,67. 10-27 Kg.
2- Définir le nombre de charge, le nombre de masse.
3- Combien peut- associer à un élément chimique de nombre de charge ? justifier.
4- L’ion et l’atome ont-ils le même élément chimique ? Justifier.
5- Calculer la masse molaire atomique de chacun des éléments suivants :
Oxygène
Uranium
Cuivre
16 8O
17 8O
18 8O
234 92U
235 92U
236 92U
63 29Cu
65 29Cu
99,76
%
0,04 %
0,20 %
0,006 %
7,14 %
92,28%
69,17
%
30,83 %
Exercice 4 :
1) La charge du noyau de l’atome de chlore ( Cl ) égale à 27,2 .10-19 C . Quel est son numéro atomique ? (On
donne la valeur de la charge élémentaire : e = 1,6 . 10-19C ) .Combien d’électrons possède cet atome ?
2)Un nucléide isotope de chlore possède 20neutrons . Ecrire le symbole de ce nucléide , en précisant son
numéro atomique et son nombre de masse.
3-On considère les atomes suivants : O(Z=8);H (Z=1);N (Z=7) ; P(Z=15) ; F(Z=9)
a)Donner le schéma de Lewis de chaque atome.
b) compléter la classification des ces atomes par
ordre d’électronégativité croissante.
c)Qu’appelle t-on liaison covalente ?
d) Combien de liaisons covalentes peut établir chaque
atome ?
e) En utilisant le schéma de Lewis , expliquer la formation des espèces chimiques suivantes :
NH3 ; H2O ; PF3 ; H3O+ et NH4+
f)Indiquer les liaisons dans la molécule de PF3 et placer les fractions de charges sur chaque atome.
A
B
C
D
électronégativité
croissante
H
* * * * *
*
1
/
2
100%