Unité XI Physique atomique et nucléaire Introduction Cette unité

Unité XI
Physique atomique et nucléaire
INTRODUCTION
Cette unité introduit les idées de base et les modèles qui ont mené à notre
présente compréhension de l’atome et de son noyau. Ensuite on étudiera ces
noyaux qui ne sont pas stables et qui mènent donc au phénomène de
radioactivité. Finalement, on fera une introduction à la physique des noyaux
atomiques en regardant à la conversion de masse en énergie lors des
processus de fission et fusion nucléaire.
1. L’ATOME
A. STRUCTURE DE L’ATOME
(i) Modèle de Thomson proposé en 1897 :
Thomson proposa que l’atome est une sphère d’électricité positive à
l’intérieure de laquelle on retrouverait des électrons. (Comparée au
point aux raisins, le raisin c’est les charges négatives et le pain c’est
les charges positives)
(ii) Expérience de Geiger-Marsden en 1909 :
Le but était de démontrer comment des particules ultrarapides
(comme des particules alphas (α) – une masses de 4 uma et une
charge de +2 - émises lors de la désintégration nucléaires
d’atomes radioactifs comme le polonium) réagiraient lors de
leur bombardement sur une mince feuille d’atomes (comme
celle d’une feuille d’or).
Hypothèses :
o Si la densité de l’atome est uniforme et donc légère les
particules α traverseront la feuille sans être déviées
mais légèrement ralenties.
o Si la masse est plus concentrée à certains endroits dans
l’atome et qu’elle est neutre ou +, certaines particules α
rebondiront en entrant en collision avec ces
+++++
+++++
+++++

concentrations de masse, le % dépendant de la grosseur
de cette concentration de masse.
o Si cette concentration de masse a une charge –, les
particules α entreront en collision avec elles et les
expulseront de l’atome.
o Si cette concentration de masse a une charge +, les
particules α pourraient être déviées de leur trajectoire
en s’approchant trop près d’elles.
Résultats :
o La grande majorité des particules α sont passées à
travers la feuille d’or sans être déviées de leur
trajectoire originale.
o Un très petit % de particules α a été diffusé selon des
angles assez importants.
o Encore moins de particules rebondissaient de retour sur
leur trajectoire originale.
Améliorations au modèle atomique selon Rutherford en
1911 :
o La plus grande proportion du volume d’un atome est de
l’espace vide.
o L’atome possède une zone centrale très petite mais
extrêmement dense et chargée positivement – le noyau
– contenant toute la charge positive de l’atome et la
plus grande partie de la masse.
o La plus grande proportion du volume d’un atome est de
l’espace vide et, à l’intérieur de cet espace vide, une
quantité d’électrons très légers chargés négativement
gravitent autour du noyau.

(iii) Modèle de Bohr
Difficulté avec le modèle de Rutherford :
Selon la théorie d’électromagnétisme, une particule chargée subissant une
accélération (que ça soit dû à un changement de vitesse ou d’orientation) émettra
de la radiation et donc perdra de l’énergie. Donc, les électrons dans le modèle de
Rutherford, qui gravitent autour du noyau devraient circuler en spiral pour
éventuellement aboutir dans le noyau. Mais, puisque les atomes existent et
qu’elles ne s’écroulent pas, ceci indique que le modèle de Rutherford était
déficient en ce qui concerne son explication du comportement des électrons et
que son modèle devait donc subir une autre modification.
Observations menant à une amélioration dans le modèle de l’atome :
Spectre d’émission obtenu des atomes d’un certain élément excité par une
source d’énergie quelconque (lumière, chaleur, bombardement par des électrons,
etc.) contient seulement des longueurs d’onde de lumière spécifique. Chaque
élément a son propre spectre d’émission qui peut donc être utilisé comme façon
d’identifier un élément inconnu.
Voici le spectre d’hydrogène (tel qu’observé par Bohr et le seul qu’il a pu
expliquer de façon mathématique) :
Postulats de Bohr pour expliquer ces observations :
1) Les électrons dans l’atome d’hydrogène (ou autre) ne peuvent exister que
dans des niveaux d’énergie discrets et bien définis sans émettre de radiation.
Chacune de ces orbites est appelée un état stationnaire. Les électrons dans un
atome occuperont toujours le plus bas niveau d’énergie disponible (pour
l’atome d’hydrogène, l’unique électron dans cet atome occupera le niveau n=1).
L’atome est alors dans son état fondamental.
2) Si l’atome à son état fondamental est excité en recevant un montant
approprié d’énergie (comme de l’énergie lumineuse, de la chaleur ou un
bombardement par des électrons), l’électron quittera le niveau d’énergie qu’il
occupe pour en occuper un autre à un plus haut niveau d’énergie. L’atome est
alors excité. Les énergies lumineuses qui sont absorbées pour que l’atome
devienne excité composent le spectre d’absorption. Si une lumière blanche
(comprenant toutes les énergies lumineuses) est envoyée au travers d’un gaz, le
spectre aura des lignes aux mêmes endroits que le spectre d’émission excepté
que les lignes seront noires et ces lignes représenteront les énergies qui ont été
absorbées par ce gaz.

3) L’atome dans un état excité fera immédiatement une ou des transitions
pour retourner alors à son état fondamental. L’électron peut seulement perdre de
l’énergie lorsqu’il fait la transition d’un état d’énergie à un autre plus bas.
L’énergie est émise sous forme de photon (ou quanta) de lumière dont l’énergie
correspond à la différence d’énergie entre les deux niveaux entre lesquels
l’électron fait la transition. Ceci correspond à une des lignes du spectre
d’émission à la page précédente. Noter que pour l’atome d’hydrogène, des
transitions électroniques entre les niveaux suivants résulteront en des
rayonnements dans certaines régions du spectre :
a) de n = 4 ou plus à n= 3 rayonnements dans l’infrarouge;
b) de n = 3 ou plus à n = 2 rayonnements dans le visible;
c) de n = 2 ou plus à n = 1 rayonnements dans l’ultraviolet.
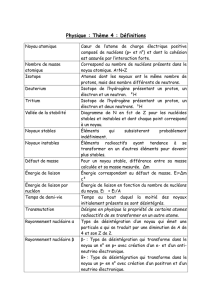
B. STRUCTURE NUCLÉAIRE
Le noyau est composé de plus petites particules, les protons et neutrons
(appelés nucléons).
Le nombre de protons dans un noyau est dénoté par Z et il est appelé le
numéro atomique.
Le nombre total de nucléons (protons + neutrons) est appelé le nombre de
masse et il est dénoté par A.
Donc, la charge d’un noyau est +Z et le nombre de neutrons est A – Z.
Un symbole sera écrit de la façon suivante pour indiquer son numéro
atomique et son nombre de masse : X où X est le symbole de l’élément dont
le numéro atomique est Z et le nombre de masse est A. Voici quelques
exemples : 11H, 24He, Ca, Pb, U.
Cette désignation peut aussi être appliquée aux nucléons. Donc le proton
est p et le neutron est n. Même si l’électron n’est pas un nucléon, on peut
aussi lui appliquer cette désignation et donc l’électron peut être écrit comme
étant e. Noter que le Z n’est pas seulement le numéro atomique mais il est
aussi la charge de la particule. Aussi, puisque l’électron est si peu massif
comparé au proton et au neutron, on lui assigne une masse de zéro.
Finalement, un photon de lumière sera représenté par le symbole grecque
gamma, γ, et puisque sa masse et sa charge sont nulles, sont symbole est γ.
Voici un résumé des particules dont tu rencontreras dans ton étude de la
physique nucléaire avec leur symbole.
Particule
Symbole
Proton
p
Neutron
n
Électron
e
Photon
γ
Particule alpha
α ou He

Un noyau avec un nombre spécifique de protons et de neutrons est appelé
un nucléide.
Les noyaux qui ont le même nombre de protons (et donc le même numéro
atomique Z) mais différents nombres de neutrons (et donc différents nombres
de masse A) sont appelés des isotopes. Puisque des isotopes ont le même
nombre de protons et donc le même nombre d’électrons, ceci implique que les
isotopes d’un même élément ont des propriétés chimiques semblables mais
des propriétés physiques légèrement différentes.
L’existence d’isotopes pour un élément donné peut être décelée à l’aide
d’un instrument appelé le spectromètre de masse. Cet instrument nous
démontre que des isotopes peuvent exister pour un élément donné et que donc
les neutrons existent dans le noyau.
Les nucléons sont liés l’un à l’autre dans le noyau par une force dont on
n’a jamais parlé avant; c’est la forte interaction nucléaire. C’est une force
attractive qui est nécessaire pour contrebalancer la force de répulsion entre les
protons positifs dans le noyau. Elle est aussi bien plus forte que la force de
répulsion entre les protons mais elle a un courte portée de seulement 10-15 m
ou moins.
Exercices :
1. Le rayon d’un noyau atomique est donné par l’expression :
R = 1,2 x A1/3 x 10-15 m
où A est le nombre de masse du noyau.
a) Utilise cette expression pour trouver la densité d’un noyau de fer
( Fe) en kgm-3.
b) Compare cette densité à la densité normale du fer (7900 kgm-3)
c) Si une étoile avec une masse 1,4 fois la masse de notre Soleil
(2,0 x 1030 kg) était pour avoir cette densité, que serait son rayon?
(De telles étoiles sont formées dans l’évolution finale d’une étoile et elles
s’appellent des étoiles à neutrons.)
2. Utilise l’expression ci-dessus pour le rayon d’un noyau et tes capacité en
manipulations mathématiques pour démontrer que tous les noyaux ont la même
densité.
3. Explique pourquoi les résultats de l’expérience Geiger-Marsden sont
incompatibles avec le modèle de Thomson et ont mené au modèle de Rutherford.
4. Explique pourquoi les lignes noires dans un spectre d’absorption ont les mêmes
longueurs d’onde que les lignes de lumière dans un spectre d’émission du même
élément.
5. Qu’est-ce qu’un isotope? Comment savons-nous qu’ils existent?
6. Trouve le nombre de neutrons dans les noyaux suivants :
a) H
b) He
c) Ca
d) Pb
7. Quelle est la charge électrique du noyau He?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
1
/
29
100%