Tir parabolique et chute libre

Correction : lumière d’étoiles
Partie A : compréhension des phénomènes.
1. Quel mot et quelle grandeur les physiciens utilisent-ils pour qualifier une couleur ?
Une couleur correspond à une radiation monochromatique, elle est caractérisée par sa longueur d’onde dans
le vide (ou dans l’air).
2. De quoi le profil spectral d’un corps chaud dépend-t-il ?
Il dépend de la température du corps émetteur de lumière.
3. Rappeler la loi de déplacement de Wien pour la lumière d’origine thermique.
Le spectre de la lumière émise par un corps chaud s’enrichit vers le violet lorsque la température du corps
chaud augmente. La longueur d’onde
max
de la radiation émise avec le maximum d’intensité est
inversement proportionnelle à la température T du corps chaud, exprimée en Kelvin (K) :
max 2,89.103
T
4. Qu’est-ce qu’un spectre de raies d’émission ?
C’est un spectre constitué de raies brillantes sur fond noir : ce spectre est discontinu.
5. De quoi le spectre de raies dépend-t-il ?
Le spectre de raies d’émission dépend de l’atome émetteur de lumière.
6. Rappeler le modèle permettant d’expliquer le caractère discontinu d’un spectre de raies d’émission.
L’atome est modélisé par des électrons en mouvement autour du noyau. Chaque électron se déplace dans
une zone appelée couche électronique. La répartition des électrons dans les couches électroniques s’appelle
la configuration électronique.
Les électrons sont susceptibles de changer de couche électronique : lorsqu’ils reviennent à leur couche
initiale, l’atome émet de la lumière.
Chaque configuration électronique est caractérisée par un état d’énergie de l’atome. Les états
d’énergie possible d’un atome sont quantifiés : ils ne peuvent prendre que certaines valeurs précises,
et pas d’autres.
Lorsqu’un électron change de couche électronique, cette transition correspond à une différence
d’énergie pour l’atome, appelée quantum d’énergie : l’énergie emportée par la lumière émise est
appelée photon, elle est égale à ce quantum d’énergie ; la fréquence de la radiation lumineuse est
donnée par relation de Planck-Einstein :
Eh
Or,
c
donc
hc
E
. La lumière n’est donc émise que pour des longueurs d’ondes
données correspondant aux transitions énergétiques possibles : on obtient un spectre de raies
d’émission.
7. Compléter les schémas des expériences réalisées par Kirchoff en représentant les spectres obtenus.
On utilise le fait que l’absorption se fait pour les mêmes longueurs d’onde que l’émission : le spectre
d’absorption présente des raies sombres sur un fond continu coloré.
Pour le sodium, on utilise l’indication du texte.

8. Expliquer l’absorption de lumière par les atomes en utilisant le modèle développé pour l’émission de
lumière.
Lors de l’absorption de lumière, un atome gagne le quantum d’énergie transporté par le photon.
L’absorption n’est possible que pour un photon de longueur d’onde donnée correspondant à une transition
énergétique possible pour l’atome. Les raies sombres correspondent aux photons de cette longueur d’onde
qui sont absorbés.
9. A l’aide des principaux niveaux d’énergie de quelques atomes (document annexe 4), retrouver la raie
d’absorption du sodium et le spectre d’absorption de l’hydrogène. On rappelle que h = 6,63.10-34 J.s et c =
3,00.108 m.s-1.
On a montré que la longueur d’onde du photon absorbé vaut
hc
E
On essaie différentes transitions en commençant par le passage de E0 à E1 :
1hc
E1E0
Attention : l’énergie doit être convertie en Joules et la longueur d’onde est alors en mètres.
16,63.1034 3,00.108
3,03(5,14)
1,6.1019 5,89.107m
soit 589 nm : on retrouve la raie d’absorption
du sodium dans le jaune.
On procède de même pour l’hydrogène et on présente le résultat sous forme de tableau :
E (eV)
transition
lambda absorbé
(m)
lambda
(nm)
couleur
0
-0,37
E1-->E5
4,10.10-7
410
violet
-0,54
E1-->E4
4,35.10-7
435
violet
-0,85
E1-->E3
4,88.10-7
488
bleu
-1,51
E1-->E2
6,58.10-7
658
rouge
-3,4
E0-->E1
1,22.10-7
122
"UV"
-13,6
On retrouve bien le spectre d’absorption dans le visible, la transition E0 vers E1 étant dans l’ultraviolet.
Vap
eur
de
mer
cur
e
(Hg
)
Lam
pe
à
inc
and
esc
enc
e
Vap
eur
de
mer
cur
e
(Hg
)
Lam
pe
à
inc
and
esc
enc
e
Spectre d’absorption de
la vapeur d’hydrogène.
Spectre d’absorption de
la vapeur de sodium.
Vapeur
d’hydrogène
Vapeur de
sodium

Partie B - Application : que nous apprend le spectre d’une étoile ?
1. Schématiser le modèle d’une étoile proposé par Kirchhoff.
2. Le document annexe 5 présente le spectre de la lumière provenant du Soleil. Quelle est l’origine du
spectre continu formant le fond coloré ?
C’est un spectre d’origine thermique : la surface chaude de l’étoile émet de la lumière.
3. Quelle caractéristique de la surface de l’étoile le profil spectral nous apprend-t-il ?
D’après la loi de déplacement de Wien, la connaissance de la longueur d’onde de la radiation émise avec le
maximum d’intensité nous permet de connaître la température de surface de l’étoile.
4. Quelle est l’origine des raies sombres observées ?
Ce sont des raies d’absorption : les atomes de l’enveloppe à basse pression absorbe de la lumière pour des
longueurs d’onde précises correspondant aux transitions énergétiques possibles des atomes.
5. Qu’est-ce que cela nous apprend sur l’enveloppe gazeuse de l’étoile ?
On peut identifier les atomes présents dans l’enveloppe gazeuse grâce à leurs spectre d’absorption.
6. Résumer les deux types d’information que l’on peut tirer du spectre d’une étoile.
On peut connaître :
- la température de surface de l’étoile à partir de la longueur d’onde de la radiation émise avec la plus
grande intensité.
- les atomes présents dans l’enveloppe gazeuse à partir des longueurs d’onde absorbées.
Partie C : mesures de quelques caractéristiques du Soleil.
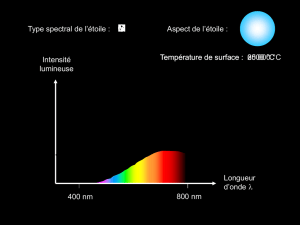
1. Pour quelle longueur d’onde observe-t-on une intensité lumineuse maximale ?
On trace à main levée l’allure du profil spectral qu’on aurait sans absorption, en rouge sur le document 5.
On mesure ensuite sur le profil spectral la longueur d’onde pour laquelle l’intensité émise est maximale :
max 460
nm
2. Estimer la température de surface du Soleil.
D’après la loi de déplacement de Wien, la longueur d’onde
max
correspondant au maximum d’intensité
lumineuse est inversement proportionnelle à la température T du corps chaud, exprimée en Kelvin (K) :
max 2,89.103
T
Boule de gaz à haute
température
Enveloppe gazeuse à basse pression

Donc :
T2,89.103
max
soit :
T2,89.103
4,60.107
6,28.103 K soit une température voisine de 6000 °C.
3. A l’aide des documents annexes 4 et 5, justifier la présence d’hydrogène dans l’atmosphère solaire.
On a montré que l’atome d’hydrogène absorbe dans le visible les photons de longueurs d’onde suivantes :
410 nm, 435 nm, 488 nm et 658 nm.
Or, on retrouve toutes ces raies d’absorption sur le profil spectral (traits verts sur la courbe).
Donc, on en déduit que l’étoile contient de l’hydrogène.
4. Le Soleil ne contient-il que de l’hydrogène ? Justifier la réponse.
On observe d’autres raies d’absorption sur le profil spectral que celles de l’hydrogène.
Or, on sait qu’un spectre de raies d’absorption est caractéristique d’un atome.
On en déduit que le Soleil contient d’autres éléments que l’hydrogène.
En particulier, on retrouve la fameuse raie d’absorption du sodium à 589 nm.

QuickTime™ et un
décompresseur
sont requis pour visionner cette image.
Document 5 : spectre de la lumière provenant du Soleil.
1
/
5
100%