2.2.1) Exemple de la diffusion facilitée du glucose

1
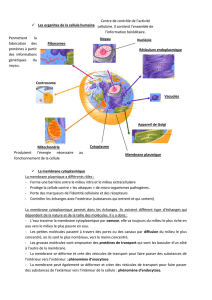
Les transports membranaires
- Toutes les oxydations ont lieu dans la cellule et les nutriments doivent arriver à son niveau
après avoir franchi les différents types de membranes qui séparent les compartiments.
Au niveau supra cellulaire, c'est un épithélium.
Au niveau cellulaire, c'est la membrane plasmique et la membrane des organites intra
cellulaires.
I) Etude de la membrane plasmique
- C'est une membrane semi-perméable, très sélective qui maintient une composition chimique
constante du milieu intra cellulaire.
1. 1) Structure de la membrane plasmique
- Toutes les membranes sont constituées d'une double couche de phospholipides.
- Des protéines incluses dans la double couche permettent d'apporter des propriétés
supplémentaires à cette double couche.
1. 2) Techniques d'étude de la membrane
1.2.1) Technique des liposomes
- On traite des cellules avec un mélange de solvants organiques : chlorofome et méthanol ou
avec un détergent.
- On isole les phospholipides par centrifugation et on les disperse dans de l'eau.
- Il y a alors formation spontanée
de vésicules – les liposomes –
comportant un milieu intérieur et
un milieu extérieur, qui permettront
l'étude des transferts.
Autre technique
Formation spontanée d'une
membrane biologique en utilisant
une solution de lipides séparée en
deux compartiments par une feuille
percée d'un trou.

2
Exemple d'une membrane lipidique artificielle sans protéine fortement imperméable aux ions
1.2.2) Coefficient de partage huile – eau
Plus un corps est susceptible de se solubiliser dans l'huile, plus il a tendance à passer cette
barrière. C'est le caractère hydrophobe des molécules qui détermine leur passage.
- Applications : - Les antibiotiques :
- La pénicilline est hydrosoluble et ne passe pas la barrière méningée
- Le chloramphénicol est hydrophobe et peut passer.
- Autres substances : l'épinéphrine, l'adrénaline, la codéine, l'héroïne, le valium, la
nicotine, l'éthanol, la caféïne passent assez facilement.

3
II) Mécanismes permettant le passage à travers la membrane
2.1) Mécanismes de diffusion
La diffusion se fait toujours dans le sens du gradient.
2.1.1) Quantification du flux (moles / min)
Jx = - Dx . S / e . (Cx1 – Cx2)
Avec : - Dx = constante de diffusion
- S = surface
- e = épaisseur de la membrane
- Cx1 – Cx2 = gradient
Loi générale de la diffusion : G = - RT . ln Cx 1 / Cx 2
C'est une variation d'énergie libre
Pour un gaz, on parle de pression partielle et pas de concentration.
Loi de Dalton :
- La pression partielle d'un gaz dans un mélange gazeux occupant un volume V est la pression
qu'exercerait ce gaz s'il occupait seul le volume V.
- La somme des pressions partielles des gaz dans un mélange représente la pression totale de
ce mélange.
PO2 disponible pour l'organisme = PO2 = (760 – 47) . 0.21 = 150 mm Hg (valeur de
référence)
Unités :
- 1 Pa = 1 force de 1 Newton / m2 unité de référence
- 1 bar = 100 kPa - 1 mbar = 1 kPa
- 1 cm d'H2O = 98.1 Pa
- 1 mm Hg = 133 Pa
- 1 atm = 101.32 kPa = 760 mm Hg = 760 Torr (en référence à Torricelli)
2.1.2) Débit d'un gaz à travers une membrane
Vx = (PAx – PBx) . S / e . Dx
- S = surface S et e = épaisseur
- PAx – PBx = différence de pression partielle de part et d'autre de la membrane
- Dx = constante de diffusion ; elle dépend de la nature du gaz et est donnée par rapport à l'O2
- DO2 = 1
- DCO2 = 20.5 le CO2 diffuse 20 fois plus vite que l'O2.
- DN2 = 0.85
- DH2 = 1.05

4
Loi de Henry : relation entre pression partielle et volume dissout
v = . P . V
Le volume v de gaz dissout dans un liquide occupant un volume V est proportionnel à la
pression partielle de ce gaz dans le liquide.
- v = volume dissout
- = coefficient de solubilité de Bunsen
- P = pression partielle du gaz
- V = volume du liquide
- O2 = 0.003 mL / 100 mL / mm Hg
- CO2 = 0.06 mL / 100 mL / mm Hg
- Le CO2 est 20 fois plus soluble que l'O2 et diffuse 20 fois mieux (on peut faire rentrer de
grands volumes de CO2 dans l'eau eau gazeuse).
Exemple de diffusion entre l'air et l'eau
- L'air et l'eau sont séparés par une membrane perméable aux gaz et imperméable à l'eau.
PO2 = 159 mm Hg = 21.27 kPa
1 L d'air contiendra : 1000 (1 L) * 0.21 = 210 mL d'O2
A l'équilibre 1 L d'eau contiendra : 159 * 0.003 * 10 = 4.77 mLO2
- L'eau contient 2.3 % de la quantité d'O2 que contient l'air
Dans l'air:
- La consommation d'O2 d'un individu = 0.25 L d'O2 / min.
Air inspiré = 21 %
Air expiré = 16 %
Apport d'O2 = 0.21 – 0.16 = 0.05 L
Pour couvrir les besoins (0.25 L / min) , il faudrait :
0.25 / 0.05 = 5 L d'air
Dans l'eau :
- Par L d'eau ventilée, on peut calculer la quantité d'O2 dissout dans l'eau :
0.00477 L sous une atmosphère contenant 21 % d'O2
0.00365 L sous une atmosphère contenant 16 % d'O2
0.00477 L – 0.00365 L = 0.00112 L d'O2
- Pour couvrir les besoins (0.25 L d'O2 / min), il faudrait :
0.250 / 0.00112 = 223 L d'eau
possible pour les animaux munis de branchies

5
2.1.3) Transport sanguin de l'oxygène
L'oxygène est essentiellement transporté par l'intermédiaire de l'hémoglobine et très peu sous
forme dissoute.
Le pouvoir oxyphorique :
- 1 g d'Hb fixe 1,34 mL d'O2
- 100 mL de sang contiennent 15 g d'Hb, donc : 1,34 mL . 15 = 20,1 mL d'O2
Grâce à l'Hb, la capacité de transport de l'O2 est de 200 mL / L de sang.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%