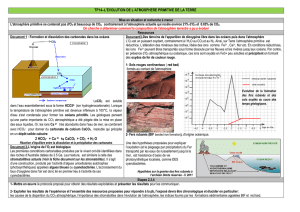
Activité I : L`atmosphère de la Terre primitive :

CHAPITRE I /Atmosphère- climats/ L’ATMOSPHRE PRIMITIVE ET SON EVOLUTION.
Problématiques :
L’atmosphère primitive, origine et composition.
Où est passé le dioxyde de carbone des débuts ?
Quelle est l’origine de l’abondance en dioxygène de notre atmosphère ?
Quelques définitions :
Isotope : Chacun des éléments de même numéro atomique (occupant la même place dans la
classification de Mendeleïev), mais de masse atomique différente (même nombre de protons, mais
nombre différent de neutrons).
Demi-vie : Temps que met une grandeur qui suit une loi exponentielle décroissante pour arriver à la
moitié de sa valeur initiale.
Activité I : L’atmosphère de la Terre primitive :
o Origine du système solaire :
Le Soleil se serait condensé à partir d'un nuage de poussières interstellaires. Lorsque le volume et la
densité du Soleil sont devenus suffisants, sa température a atteint un degré si élevé que des
réactions nucléaires se sont déclenchées. Les particules qui gravitaient autour du Soleil se sont
ensuite agglomérées pour donner naissance aux planètes il y a 4,5 milliards d'années.
L'atmosphère terrestre est unique parmi les atmosphères des autres planètes du système solaire.
Elle est riche en azote (78 %) et oxygène (21 %) et pauvre en CO2 (0.03 %). Elle contient également
de nombreux constituants mineurs, les gaz rares, comme le xénon, l'hélium ou l'argon.
o Le gaz rare argon (concentration dans l'air : 1 %).
Parmi les trois isotopes stables de l'argon (36Ar, 38Ar et 40Ar), le 40Ar représente 99,6 %. Cet isotope
est produit par la désintégration radioactive du 40K, qui se trouve dans la croûte continentale et le
manteau de la Terre. L'argon est trop lourd pour s'échapper de l'atmosphère vers l'espace. En
conséquence, l'argon présent dans l'air est le résultat d'une accumulation du lent dégazage de notre
planète pendant 4,5 milliards d'années. La demi-vie du 40K étant de 1,25 milliards d'années, cela
implique qu'une partie de ce dégazage s'est passée relativement tard pendant l'évolution de la Terre.
o L’hélium.
L'atmosphère contient une très faible quantité d'hélium (~5 ppm). Le temps de résidence de l'hélium
dans l'atmosphère est très court, de l'ordre du million d'années, ce qui montre que l'hélium de
l'atmosphère actuelle ne peut donc être d'origine primaire.
En ce qui concerne l'isotope primordial de l'hélium, le 3He, sa concentration est encore 700000 fois
plus faible. En analysant cet isotope rare dans l'eau de mer se situant au-dessus de la dorsale
pacifique (figure ci-dessous), on observe un excès d'3He. Cet excès ne peut provenir que du dégazage
des magmas lors de la formation de la croûte océanique. Ceci indique que le manteau se dégaze
toujours à l'heure actuelle.
% d’He de l’eau océanique au-dessus de la dorsale Pacifique
La composition des gaz volcaniques :

Les volcans émettent des gaz en grande quantité ; leur composition moyenne montre l’abondance de
trois gaz principaux : eau, dioxyde de carbone et azote. Ils ne contiennent pas de dioxygène.
% des principaux gaz émis par les volcans.
La composition des gaz issus des chondrites:
On considère aujourd'hui que les planètes et les météorites se sont formées en même temps par
accrétion et collision avec d'autres corps célestes. On considère donc que la composition de
météorites indifférenciées comme les chondrites correspond à la composition de la Terre primitive
indifférenciée.
Une chondrite Composition des gaz chondritiques
Les gaz obtenus par chauffage sont des indicateurs des gaz de la Terre primitive.
A partir des documents ci-dessus, proposez une composition chimique de l’atmosphère
primitive de la Terre.
On remarque que l'ordre de grandeur dans les deux cas est très proche. On peut donc considérer que
l'hypothèse est bonne et que la composition en gaz de l'atmosphère primitive est une moyenne entre
les valeurs ainsi déterminées (avec une forte marge d'incertitude).
Soulignons que la composition de l'atmosphère primitive reste une hypothèse et non un fait !
On peut donc établir un tableau de comparaison entre atmosphère primitive supposée et atmosphère
actuelle mesurée :
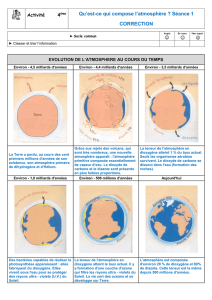
Activité II: la chute de la concentration du CO2 atmosphérique :
La courbe de concentration en CO2 (graphique ci-dessous) de l’atmosphère terrestre montre sa
diminution au cours du temps. Comment expliquer un tel phénomène ?
Chute du taux de CO2 (et d’autres gaz) au cours du temps.
Origine de l’eau terrestre :

Au début de l'évolution de la planète, la température de surface est très élevée. L'eau est donc à l'état
de vapeur. Très vite la température de surface diminue entraînant la condensation de la vapeur d'eau.
De plus, il semble que des météorites géocroiseurs (qui rencontrent l'orbite terrestre) aient augmenté la
quantité d'eau liquide à la surface du globe.
La comète Hale-Bop (les comètes ont été des fournisseurs en eau pour la Terre).
Des mesures de la proportion des isotopes de l'hydrogène, H/D (deutérium), dans des météorites
que l'on récolte actuellement sur Terre (graphe ci-dessous) confirment cet apport d'eau
extraterrestre. Les spécialistes pensent que la formation des océans a été « rapide ». Que la vapeur
d'eau ait été libérée directement lors des collisions de météorites ou secondairement par dégazage
intense du manteau supérieur, cette vapeur d'eau a pu se condenser en pluies diluviennes lorsque la
température de surface est devenue suffisamment faible. Certains arguments suggèrent qu'un ou
des océans existaient déjà quelques 150 Ma après la formation de la Terre.
CO2 et atmosphère
Le CO2 est soluble dans l'eau liquide : cette solubilité dépend notamment de la température de l'eau
(graphique ci-dessous). Dissous dans l'eau, le CO2aq (aq : aqueux) est en fait en équilibre avec des
ions hydrogénocarbonates HCO3- d'une part, des ions carbonates CO32- d'autre part. Finalement, dans
les conditions habituelles de l'eau de mer, CO2aq ne représente que 1 à 2 % du total, HCO3-
représentant 75 à 95 % (suivant le pH).
Température en °C
Quelle semble être l'origine des océans ? Quelle conséquence leur installation a-t-elle sur le taux de
CO2 atmosphérique ?
Le stockage du CO2 dans les roches carbonatées:
Enfin, en présence d'ions Ca2+, se forme du carbonate de calcium CO3Ca peu soluble qui précipite et
constitue donc une forme de stockage du CO2.
Voir : « Un stockage du CO2 grâce à des phénomènes géologiques et biologiques. B p. 83

Les géologues pensent que ces propriétés du CO2 vis-à-vis de l'eau ont été déterminantes pour
l'évolution de l'atmosphère. Le dégazage initial du manteau a produit une atmosphère très riche en
dioxyde de carbone, mais une partie importante de ce gaz a été piégée dès la mise en place de
masses d'eau liquide.
L’évolution du taux de CO2 atmosphérique depuis -600 MA :
Voir Doc. 4 p 83
Quelles informations apportent, d'une part les roches sédimentaires âgées de 3.5 Ga, d'autre part les
traces de glaciations datées de - 2,5 Ga ?
Commentez l'évolution du taux de CO2 depuis 600 Ma. Quelle relation faites-vous entre
développement du règne végétal et chute du taux de CO2 ?
Activité III: d’une atmosphère réductrice à une atmosphère oxydante :
La courbe de concentration en O2 (graphique ci-dessous) de l’atmosphère terrestre montre une
apparition il y a 2,5 GA. Comment expliquer un tel phénomène ?
Apparition du dioxygène (et d’autres gaz) dans l’atmosphère.
Les oxydes de fer :
Le fer existe dans la nature sous deux formes, ferreux (Fe2+) et ferrique (Fe3+), présentant des solubilités
différentes dans l’eau. (doc. 4 p. 85).
Afin de démontrer la nécessité de deux éléments, le dioxygène et l'eau pour obtenir de l'oxyde de fer, on peut
faire une expérience simple. On fait le montage suivant :
On rappelle que l'eau bouillie est désoxygénée dans des proportions importantes.
Au bout de quelques jours, on obtient les résultats suivants :
On constate que l'oxyde de fer n'apparait qu'en présence d'eau et de dioxygène.
Les fers rubanés ou BIF (pour banded iron formation):
La formation de Barberton, en Afrique du sud (fig. a, au niveau de la flèche rouge) contient des minerais de fer
âgés de 3 à 3,5 Ga présentant un aspect particulier caractérisé par une alternance de couches siliceuses riches
et pauvres en oxyde de fer Fe2O3 (fig. b).

Fig a. : La formation de Barberton.
Fig b. : Fer rubané de Barberton.
Les fer rubanés les plus récents remontent à -2,2 Ga.
Pourquoi peut-on dire que les fers rubanés sont d’origine sédimentaire ?
Quelle est l’origine de la couleur des dépôts siliceux riches en Fe2O3 ?
Dès lors, comment et où ont-ils pu se former ?
Les gisements d’uranium d’Afrique du Sud :
Voir Doc. 2 p. 84.
En quoi la forme des particules d'uraninite témoigne-t-elle d'un transport et d'une sédimentation à
l'état de particules ? Comparez avec la photographie du document 1. Que montre l'existence de ces
anciens gisements ?
Les red beds (« couches rouges”).
On trouve en Australie des terres rouges riches en oxydes de fer et qui se sont formées sur places.
Leur formation suppose une atmosphère riche en dioxygène. Ces formation ont tout au plus 2,2 Ga.
Red beds australiens.
Que montre le passage, il y a 2,2 Ga environ, de formations de fers rubanés aux red beds ?
 6
6
 7
7
1
/
7
100%