Imagerie ultrasonore quantitative haute fréquence : application au

Numéro d’ordre : 03 ISAL 0031 Année 2003
Thèse
IMAGERIE ULTRASONORE QUANTITATIVE HAUTE FRÉQUENCE : APPLICATION AU
SUIVI DE LA FORMATION DU SYSTÈME CARDIAQUE AU STADE EMBRYONNAIRE
CHEZ LA SOURIS
QUANTITATIVE MEASUREMENTS IN ULTRASOUND AT HIGH FREQUENCY APPLIED
TO THE EVOLUTION OF THE EMBRYONIC MOUSE CARDIO-VASCULAR SYSTEM
présentée devant
L’Institut National des Sciences Appliquées de Lyon
pour obtenir
Le grade de docteur
École doctorale : M.E.G.A. Mécanique, Énergétique, Génie civil, Acoustique
Spécialité : Acoustique
par
Johann LE FLOC’H
Maître és Physique
Université de Bretagne Occidentale
Soutenue le :
05 septembre 2003
devant la commission d’examen
Jury :
rapporteur Lori BRIDAL CR CNRS, HDR
rapporteur Frédéric PATAT MCU-PH, HDR
F. Stuart FOSTER Professeur
Gérard GIMENEZ Professeur
président Marc JANIER PU-PH
directeur de thèse Didier VRAY Professeur
Laboratoire de recherche CREATIS UMR CNRS 5515, affilié à l’INSERM, Lyon, FRANCE

Table des matières
Introduction générale 11
1 Imagerie pour le petit animal 13
1.1 Introduction aux études post-génomiques . . . . . . . . . . . . . . . . . 14
1.1.1 Du séquençage des génomes aux études post-génomiques . . . . 14
1.1.2 Quelques applications des études post-génomiques . . . . . . . . 15
1.1.3 Rôle des modalités d’imagerie pour les modèles animaux . . . . . 16
1.1.4 Modalités d’imagerie . . . . . . . . . . . . . . . . . . . . . . . . 17
1.2 La souris . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
1.2.1 Origine et anatomie de la souris . . . . . . . . . . . . . . . . . . 21
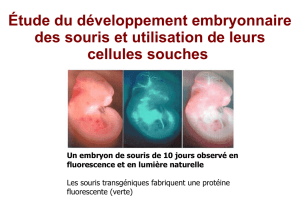
1.2.2 Le développement embryonnaire . . . . . . . . . . . . . . . . . . 27
1.2.3 Préparation de la souris en vue de l’imagerie . . . . . . . . . . . 35
1.3 ANIMAGE : Plateforme multimodale d’exploration in vivo du petit animal 38
1.3.1 Les objectifs d’ANIMAGE . . . . . . . . . . . . . . . . . . . . . 38
1.3.2 Projets en imagerie ultrasonore à ANIMAGE . . . . . . . . . . . 40
1.4 Conclusion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
2 Imagerie quantitative de la souris adulte et gestante en ultrasons 43
2.1 Mesures quantitatives en mode B et mode M . . . . . . . . . . . . . . . . 44
2.1.1 Les différentes sondes ultrasonores et les paramètres mesurés . . 44
2.1.2 Applications à la souris et aux embryons de souris . . . . . . . . 49
2.2 Mesures quantitatives en mode Doppler . . . . . . . . . . . . . . . . . . 55
2.2.1 Les différents modes Doppler et paramètres mesurés . . . . . . . 55
2.2.2 Applications à la souris et aux embryons de souris . . . . . . . . 59
2.2.3 Mesures Doppler chez l’embryon de souris 129 . . . . . . . . . 62
2.3 Mesures quantitatives en visualisation 3D . . . . . . . . . . . . . . . . . 69
2.3.1 Acquisition et visualisation 3D . . . . . . . . . . . . . . . . . . . 69
2.3.2 Applications à la souris et aux embryons de souris . . . . . . . . 70
1

TABLE DES MATIÈRES
2.3.3 Quantification 3D de l’embryon de souris à ED 14.5 . . . . . . . 72
2.4 Conclusion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3 Backscattering by blood in the mouse embryo: goals and experimental deter-
mination 77
3.1 Blood and backscattering by blood . . . . . . . . . . . . . . . . . . . . . 78
3.1.1 Blood and erythropoiesis . . . . . . . . . . . . . . . . . . . . . . 79
3.1.2 Ultrasound scattering by blood . . . . . . . . . . . . . . . . . . . 80
3.1.3 Factors influencing the backscatter coefficient . . . . . . . . . . . 83
3.2 Experimental set-up description for mouse imaging . . . . . . . . . . . . 84
3.2.1 A high frequency ultrasound scanner . . . . . . . . . . . . . . . 84
3.2.2 Mice studied and apparatus of anaesthesia . . . . . . . . . . . . . 88
3.3 Experimental methodologies for the calculation of the backscatter coeffi-
cient..................................... 92
3.3.1 Experimental methodologies to estimate the backscatter
coefficient . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 92
3.3.2 Experimental development . . . . . . . . . . . . . . . . . . . . . 96
3.4 Conclusion . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 104
4 Backscattering by blood in the mouse embryo: quantification of changes in
backscattering within the heart chambers during gestation 105
4.1 Protocol for obtaining blood samples and
haematology . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 106
4.1.1 Blood samples of mouse embryo . . . . . . . . . . . . . . . . . . 106
4.1.2 Analysis of the blood samples . . . . . . . . . . . . . . . . . . . 106
4.2 Protocol for imaging the embryonic mouse heart . . . . . . . . . . . . . . 109
4.2.1 Mouse embryo imaging . . . . . . . . . . . . . . . . . . . . . . 109
4.2.2 B-scan images of the embryonic mouse heart . . . . . . . . . . . 110
4.2.3 M-mode imaging . . . . . . . . . . . . . . . . . . . . . . . . . . 113
4.3 Power spectra analysis . . . . . . . . . . . . . . . . . . . . . . . . . . . 116
4.3.1 Frequential parameters measured with a 400 window (256
samples) ..............................116
4.3.2 Frequential parameters measured with a 200 window (128
samples) ..............................119
4.4 Apparent integrated backscatter coefficient after corrections . . . . . . . . 119
4.4.1 Apparent integrated backscatter coefficient . . . . . . . . . . . . 119
2

TABLE DES MATIÈRES
4.4.2 Discussion on factors influencing the backscatter coefficient . . . 120
4.5 Conclusions and Perspectives . . . . . . . . . . . . . . . . . . . . . . . . 126
Conclusion générale 129
Annexe A 131
Annexe B 135
3

TABLE DES MATIÈRES
4
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
1
/
155
100%