Neuro

Complications neurol. VIH et Herpès virus
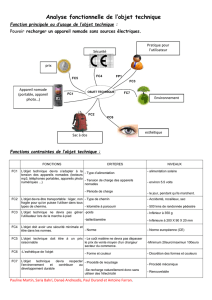
Objectifs :
1. Connaissances requises :
1.1 Connaître les principales manifestations neurologiques de la séroconversion pour le VIH.
1.2 Connaître les principales causes de neuropathie périphérique et d’atteinte du système nerveux
central survenant au cours du SIDA.
2. Objectifs pratiques :
Chez des patients réels ou simulés VIH+ ou SIDA, orienter le diagnostic en cas de :
- troubles de la marche et de l’équilibre
- troubles de la mémoire
- crise comitiale récente
Sommaire
Introduction
Faq 1 - Quelles sont les manifestations neurologiques de la primo-infection au VIH ?
Faq 2 - Quelles sont les principales atteintes du système nerveux périphérique ou du muscle à
la phase de SIDA ?
Faq 3 - Quelles sont les principales atteintes du système nerveux central à la phase de SIDA ?
Faq 4 - Quels sont les principaux effets indésirables des médicaments antirétroviraux ?
Points essentiels
Introduction
Les complications neurologiques liées à l’infection par le virus de l’immunodéficience humaine (VIH)
sont fréquentes, touchant le système nerveux central et périphérique et le muscle. Ces complications
peuvent se rencontrer à tous les stades de la maladie, de la séroconversion au stade du syndrome
d’immunodéficience acquise (SIDA). Les troubles neurologiques peuvent être liés directement au VIH,
à des infections opportunistes, à un lymphome ou être secondaires à une toxicité médicamenteuse.
Les infections opportunistes devront être systématiquement suspectées en cas d’atteinte du système
nerveux central, en particulier la toxoplasmose et la tuberculose. Certains troubles neurologiques
peuvent être réversibles spontanément ou sous traitement spécifique ; au contraire d’autres, en
l’absence de traitement efficace, seront responsables du décès.
La fréquence des manifestations neurologiques augmente avec l’augmentation de l’espérance de vie
des patients.
Faq 1 - Quelles sont les manifestations neurologiques de la primo-infection au
VIH ?
Les symptômes de la primo-infection surviennent dans un délai de 1 à 6 semaines après le contact
contaminant. La séroconversion s’accompagne dans 50 % d’un syndrome infectieux non
spécifique (fièvre, adénopathies, pharyngite, rash cutané, arthralgies et diarrhée).
Les manifestations neurologiques qui s’observent à cette phase sont variées : syndrome méningé,
encéphalite, paralysie faciale, polyradiculonévrite de type Guillain Barré, neuropathie

périphérique, myélopathie. Ces manifestations disparaissent spontanément en quelques semaines.
Biologiquement cette primo-infection s’accompagne d’un syndrome mononucléosique, d’une inversion
de la formule leucocytaire, parfois d’une élévation des transaminases. Le diagnostic repose sur la
mise en évidence d’ARN VIH plasmatique (8 à 17 jours après la contamination), ou d’antigène P24
(12 à 26 jours après la contamination), puis sur l’apparition progressive d’anticorps spécifiques.
Faq 2 - Quelles sont les principales atteintes du système nerveux périphérique
ou du muscle à la phase de SIDA ?
A - Les neuropathies périphériques
Des anomalies histologiques d’atteinte du système nerveux périphérique sont presque constantes au
stade de SIDA (95 %). Ces anomalies entraînent des manifestations cliniques significatives dans 15 %
des cas, les signes cliniques sont variés :
- les polyradiculoneuropathies aiguës peuvent se voir à des stades très variables mais surtout au
stade précoce. L’atteinte motrice bilatérale et symétrique est au premier plan accompagnée d’une
aréflexie ; le tableau clinique est comparable à un syndrome de Guillain Barré, il existe cependant une
réaction inflammatoire dans le LCR (hypercytose s’accompagnant d’une hyperprotéinorachie) ;
- les polyneuropathies axonales distales le plus souvent surtout sensitives surviennent à un
stade avancé du déficit immunitaire. Une origine toxique médicamenteuse doit toujours être
recherchée (anti-rétroviraux) surtout si le taux de CD4 est élevé ;
- les mononeuropathies et mononeuropathies multiples qui s’observent plus souvent à un stade
précoce, ont une évolution favorable et touchent les nerfs périphériques (nerf cubital, SPE, SPI) ou les
nerfs crâniens (nerf facial) ; à un stade tardif, à l’inverse, elles ont une évolution souvent rapide et
progressive ;
- les polyradiculoneuropathies (syndrome de la queue de cheval) et myéloradiculopathies
responsables d’une paraplégie hyporéflexique associée à des troubles sensitifs et sphinctériens.
Parfois liées au cytomégalovirus, elles justifient un traitement en urgence en raison des risques de
nécrose des racines et de la moelle (on recherchera systématiquement une atteinte rétinienne
associée).
B - Les myopathies
Une atteinte musculaire peut être observée à n’importe quel stade de l’infection par le VIH. Elle se
traduit dans un contexte d’amaigrissement par une polymyosite proximale associant faiblesse
musculaire et douleurs, plus rarement d’importantes difficultés à la marche occasionnant des chutes.
Le diagnostic est affirmé devant une augmentation des enzymes musculaires et par l’EMG (syndrome
myogène) et la biopsie musculaire. Ces tableaux de myopathie peuvent être liés au VIH, à
l’administration d’AZT (zidovudine) ou s’intégrer dans le cadre d’une cachexie du SIDA, à des
infections opportunistes, des infiltrations tumorales des muscles squelettiques ou à un phénomène de
vascularite. Des syndromes myathéniques et un tableau de rhabdomyolyse sont parfois décrits.
Faq 3 - Quelles sont les principales atteintes du système nerveux central à la
phase de SIDA ?
Elles surviennent le plus souvent dans un contexte de déficit immunitaire avancé. Quatre
circonstances diagnostiques feront suspecter ces complications neurologiques du système nerveux
central : un tableau de céphalées, un syndrome neurologique focal, un tableau d’encéphalite, des
troubles de la marche.
=> Devant une céphalée
La survenue d’une méningite aseptique à un stade plus avancé témoigne d’un déclin des
lymphocytes CD4+. Chez un patient sévèrement immuno-déprimé (taux de CD4 <200/mm3) toute
suspicion de méningite doit faire rechercher une cryptococcose. La symptomatologie est parfois
frustre, le syndrome méningé n’est présent que dans la moitié des cas. Le LCR révèle une cellularité
faible, l’hyperprotéinorachie et l’hypoglycorachie sont inconstantes. Le diagnostic est établi par la mise
en évidence de cryptocoque à l’examen direct (coloration à l’encre de chine) ou en culture et surtout
sur la présence d’un antigène cryptococique dans le sang ou le LCR justifiant un traitement par

amphotéricine B et fluorocytosine. L’évolution est souvent défavorable. D’autres méningites peuvent
être observées : tuberculose, listériose, syphilis.
=> Devant un syndrome neurologique focal
Un syndrome neurologique focal justifie la réalisation d’une imagerie cérébrale (TDM ou IRM)
en urgence. La confrontation entre le mode d’installation des troubles neurologiques (aiguë, subaiguë
ou progressif) et de l’aspect des lésions (prise de contraste, lésions uniques ou multiples) est
déterminante pour établir le diagnostic.
Trois étiologies seront évoquées :
1) en tout premier lieu une toxoplasmose cérébrale, la plus fréquente des infections du SNC,
responsable d’un tableau aigu associant état subfébrile, céphalées, signes de focalisation en fonction
de la localisation des abcès, crises convulsives, parfois troubles de vigilance. L’imagerie cérébrale
sans puis avec injection de produit de contraste révèle des images multiples prenant le contraste de
manière nodulaire ou en cocarde, correspondant à des abcès. Les localisations les plus fréquentes
sont les lobes frontaux et les noyaux gris centraux. La sérologie n’a d’intérêt que si elle est négative,
la technique PCR peut être utilisée dans le LCR bien que peu sensible. Un traitement spécifique doit
être introduit en urgence (pyriméthamine et sulfadiazine), son effet sera évalué sur les données
cliniques et radiologiques.
2) un tableau d’installation plus insidieuse sera évocateur d’un lymphome primitif du système nerveux
central. Les signes de localisation neurologique apparaissent souvent dans une seconde phase après
des manifestations insidieuses (céphalées, troubles mnésiques, confusion). A l’imagerie cérébrale on
observe des lésions multiples et bilatérales expansives, non spécifiques, à bords mal limités prenant
le contraste avec un faible effet de masse, siégeant préférentiellement dans le corps calleux, les
noyaux gris centraux, le thalamus, les régions péri-ventriculaires et le cervelet.
3) si le tableau est subaigu ou progressif et que le scanner objective des lésions hypodenses, il faudra
évoquer une leucoencéphalopathie multifocale progressive, affection démyélinisante due à un
papovavirus qui infiltre les oligodendrocytes, le virus JC qui peut être détecté dans le LCR par PCR.
Les manifestations cliniques sont celles d’une encéphalite progressive (signes de focalisation, crises
convulsives, ataxie, troubles visuels) sans fièvre avec parfois altération des fonctions supérieures ou
troubles psychiatriques. L’IRM est l’examen de choix pour confirmer le diagnostic révèlant des images
confluantes hypo-intenses de la substance blanche en T1, hyper-intenses en T2 ou FLAIR, sans effet
de masse, ne prenant pas le contraste.
Il n’existe pas de traitement spécifique. Une amélioration clinique peut s’observer si la restauration
immunitaire est obtenue par un traitement anti-rétroviral.
D’autres causes de lésions cérébrales focalisées sont parfois rencontrées : abcès tuberculeux,
encéphalite à cytomégalovirus ou liée à l’herpès.
=> Devant un tableau d’encéphalite
1) Un tableau d’encéphalite ou une altération des fonctions supérieures chez un sidéen peuvent avoir
plusieurs origines, mais c’est l’encéphalite au VIH qui est le principal responsable. La fréquence de
cette complication a diminué depuis l’introduction des trithérapies anti-rétrovirales. Manifestation
tardive, le début est insidieux caractérisé par un syndrome dépressif, des troubles de mémoire, un
ralentissement idéomoteur, des troubles de la concentration et de l’attention. La pente évolutive des
troubles cognitifs est variable d’un patient à l’autre. A un stade plus avancé elle se traduit par un
syndrome démentiel évident de type sous-cortical, les troubles cognitifs s’associant à des troubles du
comportement (apathie, indifférence, isolement), des troubles de l’équilibre, une tétraparésie, des

myoclonies ou des crises convulsives. L’IRM révèle une atrophie cérébrale et une atteinte diffuse
multifocale sous-corticale de la substance blanche (hypersignaux en T2 bilatéraux et symétriques
périventriculaires prédominant dans les lobes frontaux et pariétaux). L’évolution est le plus souvent
défavorable.
2) Lorsque le mode d’installation des troubles est brutal ou subaigu associant au tableau d’encéphalite
une atteinte des nerfs crâniens, un syndrome de la queue de cheval ou une méningo-radiculo-myélite
et une atteinte multiviscérale (rétinienne, pulmonaire, digestive...), il faut évoquer une encéphalite à
cytomégalovirus. C’est la plus fréquente des infections opportunistes à la phase tardive du SIDA.
L’IRM révèle alors une prise de contraste méningée périventriculaire (ventriculite) et parfois une
hydrocéphalie. Le diagnostic repose sur la présence du CMV dans le LCR soit en culture ou par
technique PCR. La réponse au traitement antiviral [ganciclovir (Cymevan ®) ou foscarnet (Foscavir
®)] est souvent modeste et de courte durée.
=> Devant un trouble de la marche
Il peut s’agir d’une neuropathie débutante ou d’une polymyosite (cf supra). Une myélopathie
vacuolaire doit également être évoquée. Elle se manifeste par un déficit moteur des membres
inférieurs évoluant vers un tableau de paraparésie spastique avec des troubles sensitifs modérés et
des troubles sphinctériens. Le diagnostic différentiel doit être établi avec des atteintes médullaires
zostériennes, herpétiques et à CMV, la toxoplasmose ou un lymphome sont parfois incriminés.
Faq 4 - Quels sont les principaux effets indésirables des médicaments
antirétroviraux ?
Parmi les inhibiteurs nucléosidiques de la transcriptase inverse la didanosine, la zalcitabine et la
stavudine peuvent être responsables de l’apparition d’une polyneuropathie.
Certains inhibiteurs de protéase (ritonavir, amprénavir) peuvent entraîner l’apparition de céphalées,
vertiges et paresthésies ; il en est de même pour les inhibiteurs non nucléosidiques notamment
l’efavirenz qui peut induire également un syndrome confusionnel et des crises convulsives.
Comme il a été dit plus haut, l’administration de zidovudine (AZT) peut être responsable de
myopathie.
Points essentiels
- Les manifestations neurologiques au cours du SIDA se rencontrent à tous les stades de la maladie,
liées directement au VIH, à des infections opportunistes, à un lymphome ou d’origine
médicamenteuse.
- Primo-infection : un syndrome infectieux non spécifique peut s’associer à un syndrome méningé, une
encéphalite, une paralysie faciale, une polyradiculonévrite, une neuropathie périphérique ou une
myélopathie.
- Stade SIDA : l’atteinte du système nerveux périphérique et musculaire (polymyosite proximale) peut
s’associer à une atteinte du système nerveux central justifiant une IRM. Les signes neurologiques sont
variés : céphalée (une méningite aseptique oriente vers une cryptococcose), signes de focalisation
(toxoplasmose, lymphome, leucoencéphalopathie multifocale progressive), encéphalite (au VIH ou à
cytomégalovirus).
- Une origine iatrogène par les antirétroviraux doit toujours être évoquée.

Complications neurologiques de l’alcoolisme
Objectifs :
¤ Connaître les signes cliniques des principales complications neurologiques de l’alcoolisme
aigu et chronique.
¤ Chez un patient alcoolique chronique :
- argumenter l’origine alcoolique des symptômes et signes.
- proposer un traitement préventif et curatif.
Sommaire
Faq 1 - Qu’est-ce que l’alcoolisme et comment intervient l’alcool sur le système nerveux ?
Faq 2 - Quelles sont les complications de l'intoxication alcoolique aiguë ?
Faq 3 - Quels sont les signes et traitements du syndrome de sevrage ?
Faq 4 - Quels sont les signes et traitements des différentes neuropathies alcooliques ?
Faq 5 - Quelles sont les complications musculaires de l'alcoolisme ?
Faq 6 - Quels sont les signes, complications et traitements de l' encéphalopathie de Gayet-
Wernicke ?
Faq 7 - Quels sont les signes et traitement de l’encéphalopathie pellagreuse ?
Faq 8 - Quels sont les signes et traitement de l'encéphalopathie hépatique ?
Faq 9 - Quelles sont les différentes causes possibles de démence chez un alcoolique
chronique ?
Faq 10 - Quels sont les signes de l’atrophie cérébelleuse alcoolique ?
Faq 11 - Quelles sont les causes et complications vasculaires aiguës et chroniques de
l'alcoolisme?
Faq 12 - Quels sont les signes de la myélinolyse centropontine ?
Faq 13 - Signes et diagnostic de la maladie de Marchiava-Bignami ?
Faq 14 - Qu’est-ce que le syndrome alcoolique fœtal ?
Points essentiels
Faq 1 - Qu’est-ce que l’alcoolisme et comment intervient l’alcool sur le système
nerveux ?
L’alcoolisme représente une cause directe ou indirecte de 15 à 25 % des hospitalisations et d’environ
35 000 décès par an en France. La reconnaissance d'un alcoolisme chronique est le plus souvent
aisée : consommation excessive lorsqu’elle est avouée, présence de plusieurs signes physiques, de
complications hépatiques, de l'association de plusieurs complications neurologiques et d'indices
biologiques (macrocytose, augmentation des gamma-GT).
Plusieurs mécanismes peuvent expliquer les effets de l'alcool sur le système nerveux. Les
complications neurologiques de l'alcoolisme peuvent en effet résulter 1) des effets toxiques propres de
l'alcool, 2) des carences associées et des conséquences indirectes par atteinte d'autres fonctions (ex :
hépatique, cardiaque, coagulation), 3) ou encore de troubles induits (ex : traumatismes, accidents).
L'alcool se fixe sur les phospholipides de membrane, entraîne une dysfonction des canaux ioniques,
se fixe sur les récepteurs notamment du système gabaergique et glutamaergique.
Il faut veiller à ne pas trop facilement attribuer une symptomatologie neurologique au seul alcoolisme
connu d'un patient, mais s'efforcer de rechercher toute autre cause potentielle. Ces complications
doivent être prévenues en assurant un complément en vitamines notamment B1 chez un patient
alcoolique et dénutri.
Il est nécessaire chez tout patient alcoolique hospitalisé de prescrire un supplément vitaminique B1,
B6, B12, folates et PP.
La consultation ou l'hospitalisation pour ces complications, dont plusieurs peuvent être associées, est
l'occasion d'envisager avec le patient sa situation personnelle sociale et professionnelle, de donner
des informations sur les différentes modalités possibles de prise en charge, d'aide sociale et
psychologique et sur les possibilités de sevrage en ambulatoire ou lors d'une hospitalisation.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
1
/
192
100%