Nerf optique - site de l`association GENS

Atteintes isolées des nerfs crâniens
[17-085-B-10]
Bernard Lechevalier : Professeur de Neurologie
Service de neurologie Dejerine, centre hospitalo-universitaire de Caen, avenue de la Côte de
Nacre, 14033 Caen cedex France
Vincent de la Sayette : Praticien hospitalier
Stéphane Schaeffer : Chef de clinique
Christian Schupp : Attaché d'audiologie
Françoise Bertran : Praticien hospitalier
Gwénaël Raoul : Interne en chirurgie
centre hospitalo-universitaire de Lille, 59000 Lille France
Résumé
Introduction
Noyaux efférents
Noyaux afférents
Nerf olfactif
Sémiologie
Étiologies des anosmies et des hyposmies
Nerf optique
Rappel anatomique
Imagerie du nerf optique
Sémiologie du nerf optique
Étiologie des neuropathies optiques
Paralysies isolées des nerfs oculomoteurs
Aspects anatomiques
Aspects cliniques
Imagerie des nerfs oculomoteurs
Étiologies
Nerf trijumeau
Rappels anatomiques
Aspects cliniques
Nerf facial
Rappel anatomique
Séméiologie
Diagnostic topographique
Électromyographie
Stimulation magnétique
Étiologie des paralysies faciales périphériques
Traitement des séquelles d'une paralysie faciale périphérique
Spasmes faciaux non paralytiques
Nerf cochléovestibulaire
Nerf cochléaire
Nerf vestibulaire
Nerf glossopharyngien
Rappel anatomique
Sémiologie
Étiologies

Nerf pneumogastrique ou nerf vague
Rappel anatomique
Sémiologie
Étiologies
Nerf spinal
Rappel anatomique
Sémiologie
Étiologies
Nerf grand hypoglosse
Rappel anatomique
Sémiologie
Étiologies
Introduction
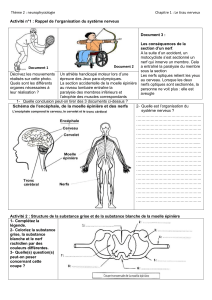
À part le nerf olfactif (1e paire crânienne) et le nerf optique (2e paire crânienne) qui ne sont
pas de vrais nerfs crâniens, les dix autres comprennent des fibres nerveuses afférentes,
efférentes ou le plus souvent les deux, qui prennent naissance ou se terminent dans les noyaux
du tronc cérébral dont la systématisation en six colonnes nucléaires est aujourd'hui adoptée
universellement [23, 24, 86]. Le sulcus limitans visible sur le plancher du 4e ventricule sépare
les noyaux efférents en dedans et les noyaux afférents en dehors.
Noyaux efférents
Les noyaux efférents somatiques généraux (GSE) forment une longue colonne qui prolonge
vers le haut la corne antérieure de la moelle, située sous le plancher du 4e ventricule près de la
ligne médiane. Ils comprennent les noyaux du III, IV, VI, XII. Ils innervent des muscles
d'origine somitique.
Les noyaux efférents viscéraux spéciaux (SVE) situés en dehors des précédents comprennent
les noyaux du trijumeau moteur, du facial, et le noyau ambigu constitué de neurones moteurs
distribués aux IX, X, XI.
Les noyaux efférents viscéraux généraux (GVE) d'origine parasympathique comprennent dans
le mésencéphale le noyau d'Edinger-Westphal, partie la plus rostrale du noyau du III, dans la
protubérance le noyau salivaire supérieur (VII), dans le bulbe les noyaux salivaire inférieur
(IX) et dorsal du X. C'est la colonne la plus externe des noyaux efférents. Le faisceau
corticobulbaire ou géniculé (ainsi appelé parce qu'il descend dans le genou de la capsule
interne) est considéré comme une partie du faisceau corticospinal (ou pyramidal). Dans son
trajet il détache des fibres pour les noyaux des nerfs crâniens auxquels il s'unit soit
directement soit par l'intermédiaire d'interneurones ou de la formation réticulée. Les
projections sont bilatérales pour les noyaux des muscles oculomoteurs, masticateurs sauf le
ptérygoïdien externe, supérieurs de la face, linguaux sauf le géniogliose et pour le noyau
ambigu. Elles sont controlatérales pour les noyaux du territoire facial inférieur, du
ptérygoïdien externe du géniogliose. Elles sont ipsilatérales pour le noyau du spinal externe.
[24]
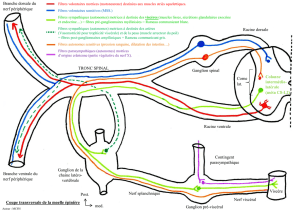
Noyaux afférents

Noyaux afférents viscéraux généraux et spéciaux
Les afférences générales viscérales (GVA) issues de cavités et des viscères céphaliques
(pharynx, larynx, fosses nasales, trachée, oesophage) se terminent via le IX et le X dans le
faisceau solitaire. Les afférences gustatives véhiculées par la corde du tympan appartenant au
VII bis, le IX et le X se terminent également dans le faisceau solitaire, dans sa partie rostrale.
Les noyaux afférents somatiques généraux (GSA) situés en dehors des précédents, sont les
trois noyaux du trijumeau qui assurent l'innervation sensitive cutanéomuqueuse de la face. La
sensibilité thermoalgésique gagne la racine descendante qui reçoit également des fibres des
VII bis, IX, X et d'après Burt [24] quelques fibres sensitives mêlées aux fibres motrices des
III, IV, VI, XII.
Les afférences somatiques spéciales (SSA) sont représentées par les noyaux
cochléovestibulaires situés en dehors des précédents. Un contrôle du faisceau corticobulbaire
sur les noyaux afférents des nerfs crâniens est depuis longtemps admis [23]. Actuellement, on
insiste surtout sur le rôle antalgique de la substance grise périaqueducale enképhalinergique et
du nucleus raphe magnus sérotoninergique.
Nerf olfactif
La muqueuse olfactive de la partie postérieure des fosses nasales ou " tache olfactive "
contient des cellules épithéliales et des neurones olfactifs, seuls neurones de l'organisme à
régénérer après leur mort, à partir de cellules épithéliales spéciales dites basales [24]. Ces
neurones sont munis de cils, porteurs à leur extrémité de chimiorécepteurs dont les gènes sont
aujourd'hui codés [6] et qui sont excités par les gaz odorants. Leurs axones traversent la lame
criblée de l'éthmoïde et se terminent dans le bulbe olfactif où ils font relais dans trois couches
de cellules nerveuses : les couches granulaires, mitrales, glomérulaires. Le fonctionnement du
bulbe olfactif n'est pas encore totalement élucidé. Il est possible que chaque neurone sensoriel
dispose de plusieurs types de récepteurs moléculaires [49] et que les axones se terminent sur
plusieurs granules. A chaque odeur correspondrait une représentation spatiale définie des
glomérules et des cellules mitrales excitées (ibidem). Le bulbe olfactif reçoit en outre des
projections non olfactives : noradrénergiques (du locus caerulus), sérotoninergiques et surtout
cholinergiques issues de la bandelette diagonale de Broca et des noyaux médians du septum.
Certaines cellules distinctes de l'épithélium olfactif principal appelées voméronasales ne sont
sensibles qu'aux odeurs impliquant un comportement sexuel (phéromones) et se projettent
dans le noyau amygdalien et non dans le cortex olfactif. Ce qui a fait écrire à Axel [6] " La
plupart des mammifères y compris l'homme possèdent un "nez sexuel" ".
Le tractus ou pédoncule olfactif prolonge vers l'arrière le bulbe olfactif. Il se divise en deux
racines, ou stries olfactives, qui délimitent l'espace perforé antérieur, une troisième racine plus
petite est visible entre les deux précédentes. La terminaison des stries olfactives est complexe.
La description varie d'un ouvrage à l'autre.
La strie olfactive latérale (ou externe) se termine d'après Burt [24] dans le cortex olfactif dit
piriforme et le noyau amygdalien. Le cortex piriforme est la partie antérieure du gyrus
parahippocampique (appartenant à T5) ; il comprend trois couches de neurones (paléocortex),
il recouvre l'amygdale et se recourbe pour former l'uncus. Quelques fibres se terminent dans
l'espace perforé antérieur, dans le noyau de la strie latérale (paléocortex appelé gyrus olfactif
latéral), le cortex entorhinal (aire 28), l'hippocampe, la strie terminale.

La strie olfactive médiale est composée de fibres venant du noyau olfactif antérieur situé dans
le pédoncule olfactif. Les fibres controlatérales atteignent le bulbe par la commissure blanche
antérieure. Des fibres ipsilatérales gagnent l'espace perforé antérieur les noyaux médians du
septum, la strie terminale.
La strie intermédiaire se termine dans le tubercule olfactif qui la prolonge. Des fibres
secondaires gagnent le noyau dorsomédian du thalamus, l'hypothalamus, le cortex
orbitofrontal, le cortex piriforme.
Le bulbe et le nerf olfactifs sont vascularisés par les artères ethmoïdales antérieures et
postérieures, branches de l'artère ophtalmique.
Sémiologie
Doty [97] a constaté que la qualité de l'odorat était meilleure chez la femme que chez
l'homme. Dans les deux sexes, les meilleures performances s'observent entre 30 et 50 ans,
elles diminuent après 60 ans. Le plus souvent méconnue l'anosmie est une découverte de
l'examen systématique. Souvent, le malade se plaint de troubles fins de la gustation (d'origine
olfactive) alors que les quatre perceptions élémentaires gustatives vraies (amer, acide, salé,
sucré) sont conservées. Pour explorer l'olfaction, on demande au sujet d'identifier les yeux
fermés des substances non irritantes (ammoniaque, acide citrique). Le café, le musc, le
phényl-éthanol n'excitent que les terminaisons olfactives. On explore chaque narine
séparément. Une étude quantitative précise peut être faite par un olfactomètre, rarement
utilisé. On peut déterminer un " seuil olfactif " et une " fatigabilité olfactive ".
Les perturbations qualitatives de l'olfaction, appelées parosmies ou cacosmies, quand elles
sont nauséabondes, sont fréquentes chez les sujets âgés déprimés. L'anosmie hystérique se
décèle par l'absence totale de perturbation du goût. Des hallucinations olfactives sont
fréquentes dans l'épilepsie partielle complexe, elles sont généralement critiquées par le
malade. Au contraire, dans la psychose hallucinatoire chronique, les hallucinations s'intègrent
dans un contexte délirant. La mémoire olfactive a des propriétés tout à fait différentes des
autres types de mémoire. En particulier, elle ne permet généralement pas le rappel vrai [69].
Étiologies des anosmies et des hyposmies
Ce diagnostic étiologique nécessite un bon examen rhinoscopique et une bonne imagerie des
diverses formations de la base antérieure du crâne.
• Il faut tout d'abord rechercher une rhinite, une tumeur des fosses nasales.
• Les fractures de l'étage antérieur de la base du crâne, en particulier de l'éthmoïde, de
simples traumatismes crâniens sans fractures s'accompagnent souvent d'anosmie par
étirements des filets du nerf olfactif immobilisés dans la lame criblée. La régression
complète s'observe dans 40 % des cas mais elle peut demander plusieurs années.
• Le bulbe olfactif et les filets du nerf peuvent être atteints par une méningite purulente
ou tuberculeuse, un envahissement néoplasique, une maladie de Paget.
• On peut observer une anosmie, parfois révélatrice dans les tumeurs de l'étage antérieur
de la base du crâne (méningiomes, tumeurs frontales médianes) de l'étage moyen
(craniopharyngiomes, adénome hypophysaire chordome, tumeurs du IIIe ventricule)
mais aussi au cours des anévrysmes des artères communicante antérieure et cérébrale
antérieure. L'encéphalite herpétique qui atteint avec prédilection le lobe temporal peut

comporter avant tout autre symptôme des hallucinations olfactives. Enfin, l'examen
d'imagerie par résonance magnétique (IRM) permettra parfois de découvrir des lésions
temporales minimes dans le cadre des hallucinations au cours de crises partielles
complexes.
• Le diabète, l'avitaminose B12 sont réputés pouvoir donner des anosmies.
• La dysplasie olfactogénitale ou syndrome de De Morsier et Kallmann est souvent
associée à d'autres troubles neurologiques portant sur la vision des couleurs, l'acuité
auditive. Ce syndrome serait lié à l'X et de transmission dominante à pénétrance
incomplète. L'hyposmie peut être associée à un hypogonadisme, ou isolée (pour revue
cf [73]).
• Dans les maladies dégénératives du système nerveux central on a signalé des anosmies
et des hyposmies [97]. Dans la maladie d'Alzheimer, Becker et al [13] notent leur
existence dans 29 % des cas. Kesslack et al [61] ont trouvé un déficit de
l'identification des odeurs et de la mémoire olfactive contrastant avec une bonne
discrimination des odeurs. Morgan et al [79] font du défaut d'identification des odeurs
un " marqueur " précoce de la maladie. Dans la maladie de Parkinson, Ward [97] a
montré la grande fréquence des troubles de la détection et de la discrimination des
odeurs. Moberg [76] a fait la même constatation en ce qui concerne la maladie de
Huntington.
Nerf optique
Le nerf optique, simple évagination du tube neural n'a pas la structure d'un nerf périphérique.
Par sa myélinisation et les trois tuniques méningées qui se prolongent sur toute sa longueur il
appartient en propre au système nerveux central. Son éloignement anatomique du tronc
cérébral achève de le distinguer des 10 dernières paires crâniennes. Ces caractéristiques
fondent l'originalité des processus pathologiques qui peuvent l'affecter aux confins de la
neurologie et de l'ophtalmologie.
Rappel anatomique
Le nerf optique relie la papille au chiasma. Il est formé des fibres issues des cellules
ganglionnaires de la rétine, deutoneurones de la voie visuelle. Elles font suite directement aux
cellules bipolaires (premier neurone) qui sont elles-mêmes directement reliées aux cellules
photosensibles, cônes et bâtonnets. Les prolongements des cellules ganglionnaires convergent
vers la papille pour former le nerf optique qui comprend trois segments : orbitaire,
intracanaliculaire, intracrânien.
• La papille est un disque ovalaire de 1,5 mm de grand axe vertical situé légèrement en
dedans du pôle postérieur de la rétine. Les fibres nerveuses rétiniennes convergent
vers la papille dont elles forment la partie la plus superficielle (couche des fibres
optiques) puis s'incurvent à angle droit vers l'arrière. La structure centrale de la papille
est la lame criblée, percée d'orifices pour le passage des fibres optiques. En arrière de
la lame criblée, le nerf optique est constitué et les fibres deviennent myélinisées.
Accessible à l'ophtalmoscope, véritable image endoscopique du système nerveux
central, la papille est un élément sémiologique fondamental du nerf optique et de sa
pathologie. Elle apparaît rose pâle, à bord net légèrement excavé, l'artère et la veine
centrale de la rétine émergeant et se divisant au fond de l'excavation.
• Le nerf optique est entouré sur toute sa longueur par les trois feuillets méningés, la
dure-mère se prolongeant au-delà de la lame criblée par la sclère. Son segment
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
1
/
63
100%