La diarrhée épidémique porcine : quel risque en France ? Comment

Ladiarrhéeépidémiqueporcine:quelrisqueenFrance?
Comments’ypréparer?
BéatriceGRASLAND,LionelBIGAULT,CéciliaBERNARD,MathieuANDRAUD,YannickBLANCHARD,
NicolasROSE
AnsesLaboratoiredePloufragan/Plouzané,BP53,22440Ploufragan,France
Ladiarrhéeépidémiqueporcine:quelrisqueenFrance?Comments’ypréparer?
Uneépizootiesévèredediarrhéeépidémiqueporcine(DEP)affectelesEtats‐Unisdepuis2013ets’étendaujourd’huiàplusieurs
paysdanslemonde.Lessignescliniquessontunediarrhéeaqueusepouvantêtreaccompagnéedevomissements.Lesporcelets
souslamèresontlesanimauxprincipalementaffectésetlestauxdemortalitéobservéschezcettecatégoried’animauxlorsde
cetteépizootieatteignent95‐100%.Lesanimauxadultespeuventêtretouchésmaisletauxdemortalitéestaumaximumde5%.
LamaladieestcauséeparunalphacoronavirusappelévirusdelaDEP(vDEP)etquineprésentepasdecaractèrezoonotique.Les
nouveauxvariantsdevDEPisolésdepuis2013montrentunepathogénicitéaccrueparrapportauxsouchesdevDEPcirculant
danslesannées80enEuropeetparrapportauxsouches«InDel»isoléesultérieurementauxEtat‐Unis.Ladoseminimale
infectantedecesnouveauxvariantsdevDEPesttrèsfaibleetlevirusprésenteunerésistanceimportanteàdifférents
traitementsphysiques.Lesdonnéesépidémiologiquesmettentenévidenceque,au‐delàdesanimauxvivantsinfectés,levDEP
peutêtrepropagéefficacementparl’activitéhumainelorsd’interventiondanslesélevages(transportmécanique),oupar
l’intermédiairedematérielcontaminé.EnFrance,l’immunitédepopulationvis‐à‐visduvDEPestfaibleetlaDEPyaétéajoutée
àlalistedesdangerssanitairesdepremièrecatégorie,rendantobligatoireladéclarationdetoutcasdeDEP.Encas
d’introductionenFrance,seuleuneidentificationrapideduoudespremier(s)cassuivied’unemiseenplacerapidedemesures
degestioncombinéesàdesmesuresdebiosécuritéstrictesseraitenmesuredelimiterlapropagationdelamaladie.
Porcineepidemicdiarrhea:whatistheriskofintroductionintoFrance?Whatcanwedo?
Anacuteepizootyofporcineepidemicdiarrhea(PED)hasaffectedtheUSAsince2013andisnowspreadingtoseveralcountriesall
aroundtheworld.Clinicalsignsarerepresentedbyprofuseaqueousdiarrhea,sometimeswithvomiting,mainlyobservedin
sucklingpigletswithamortalityratereachingupto95‐100%inthisanimalcategory.Adultanimalscanalsobeaffectedwitha
lowermortalityrate(maximum5%).Theetiologicalagentisanon‐zoonoticalphacoronavirus,namedporcineepidemicdiarrhea
virus(PEDV).NewvariantsofPEDVisolatedin2013displayedahighpathogenicitycomparedbothtostrainspreviouslyisolatedin
Europeinthe80’sandtoInDelPEDVstrainssubsequentlyisolatedintheUSA.TheminimalinfectiousdoseofthesenewPEDV
variantsisverylowandPEDVishighlyresistanttophysicaltreatments.Beyondinfectedliveanimals,PEDVcanbeefficiently
propagatedbypeoplecomingintoherds(mechanicalcarriers)orthroughtheuseofpotentiallycontaminatedmaterial.InFrance,
theimmunestatusofthepigpopulationagainstPEDVislowandPEDisnowclassifiedinthelistofthefirstcategoryofanimal
healthhazards,makingnotificationofallcasescompulsory.IntheeventofintroductionintoFrance,onlyafastidentificationof
thefirstcase(s)willmakeitpossibletoimplementcontrolmeasuresrapidly,togetherwithincreaseofbiosecuritytolimitthe
spreadofthedisease.
2015. Journées Recherche Porcine, 47, 259-264.
259

INTRODUCTION
Ladiarrhéeépidémiqueporcine(DEP)aétédécritepourla
premièrefoisenAngleterreen1971(Oldman,1972).Ellese
traduitpardesdiarrhéesliquidesetdesvomissementschezles
porceletsmaiségalementchezlesanimauxenengraissement.
LaDEPprésentedessignescliniquessimilairesàlagastro‐
entéritetransmissible(GET),cesdeuxmaladiesétantcausées
paruneinfectiondueàdesalpha‐coronavirusdistincts.
Levirusdeladiarrhéeépidémique(vDEP)aétéidentifiéen
1978,associéàdescasdediarrhéeliquideetlasoucheisolée,
appeléeCV777,estconsidéréecommelasoucheeuropéenne
deréférence(ChaseyetCartwright,1978;Pensaertetde
Bouck,1978).LevDEPdiffèreauniveaugénomiqueet
antigéniqueduvirusdelaGET.
1. SITUATIONEPIDEMIOLOGIQUE
1.1. EnAmérique
ApartquelquescassporadiquesdeDEPdécritsauCanada
danslesannées1980,lesEtats‐Unisetl’Amériquelatine
étaientindemnesdeDEPjusqu’en2013(RoseandGrasland,
2014).Finavril2013,despremierscasdeDEPontétéobservés
auxEtats‐Unis,toutd’aborddansl’étatdel’Iowa,avecdes
tauxdemortalitécomprisentre95et100%chezlesporcelets
souslamère(Stevensonetal.,2013).L’épizootieesttoujours
encoursavec,chaquesemaine,denouveauxélevagesaffectés
(Figure1).Trente‐deuxétatsetplusde8300élevagesontété
touchés,entraînantlamortdeplusdehuitmillionsdeporcs.
Actuellement,deuxtypesdesouchescirculentauxEtats‐Unis.
Lespremièressouchesappartenantaugénogroupe1ontété
identifiéesdès2013audébutdel’épizootieetsont
extrêmementvirulenteschezlesporceletssouslamère
(Huangetal.,2013;Stevensonetal.,2013).Lesecondtypede
souchesappartientaugénogroupe2etaétéidentifié
ultérieurement.Cessouches,appelées«InDel»présentent
unedélétionetuneinsertiondanslarégionNterminaledu
gènecodantlaprotéineSduvDEP.Cessouchesseraient
associéesàdescascliniquesmoinssévèresdanslesélevages
etaffecteraientplutôtlesporcsadultes(Okaetal.,2014;
Wangetal.,2014).LespremièressouchesisoléesauxEtats‐
Unis,appartenantaugénogroupe1,ontmontré99,5%
d’homologieavecunesoucheisoléelorsd’épisodessévèresde
DEPenChineen2012(Huangetal.,2013).
Figure1–Donnéesd’incidencehebdomadaireauxUSA
depuisledébutdel’épizootieenavril2013
(d’aprèshttp://www.aasv.org)
L’épizooties’estpropagéeauCanadaenfévrier2014,
atteignantl’Ontarioprincipalement(58élevagestouchésau10
mai2014)maisaussileManitoba(2élevages),leQuébec
(1élevage)etl’îleduPrinceEdouard(1élevage).LaDEPa
progressédefaçonrelativementmodéréeetlenombredecas
estrestéstabledepuisfinJuillet2014pouratteindre63cas
danslaprovincedel’Ontario,2danscelleduManitoba,1dans
celleduQuébecet1cassurl’îleduPrinceEdouard.
AuMexique,ledébutdel’épizootieestdatéau30juillet2013
(Fajardoetal.,2014)etelles’estpropagéeàlapartiecentraleet
occidentaledupays.Elleatouché83élevagesdans17états.Sur
2309prélèvementscollectésdans19étatsentreaoût2013et
mai2014,30%sesontavéréspositifspourlevDEP.
EnColombie,desépisodesaigusdediarrhéeconduisantàde
lamortalitéchezdesporceletssouslamèreontatteint45
élevages.LevDEPabienétéconfirmécommeétantl’agent
étiologiqueetlesdonnéesdeséquençageindiquentuneforte
proximitéégalementvisàvisdessouchesaméricaines.Enfin,
desisolatsdevDEPontétécaractérisésenoctobre2013au
Pérouetétaientprochesgénétiquementdessouchesnord‐
américaines(More‐Bayonaetal.,2014).EnArgentine,en
UruguayetauBrésil,premierpaysproducteurdeporcsen
AmériqueduSud,aucuncasdeDEPn’aétédécrit.
1.2. EnAsie
EnChine,lamaladieétaitprobablementprésentedemanière
enzootiqueavant2010‐2011,maisuneformeplussévèreet
épizootiquesembleavoirémergéfin2010,malgrél’utilisation
courantedelavaccination(vaccinbasésurlasoucheCV777
atténuée)danscepays(Lietal.,2012).Dessouches
appartenantaugénogroupe1circulentenChinedepuis2011
etsontimpliquéesdanscesépizootiessévèresdeDEP.Mais
d’autressouchesappartenantaugénogroupe2circulent
actuellementenChine(Wangetal.,2013).
Aprèsseptansd’absence,lamaladieestégalementapparue
auJaponenoctobre2013.Trente‐huitpréfecturessur47ont
ététouchéeset817élevagesaffectésprovoquantlamortde
371000porcs.Depuislami‐avril2014,l’incidencesembleen
diminution.Lesvirusisoléslorsdecesépisodessontproches
génétiquementdessoucheshypervirulentesdugénogroupe1
identifiéesenChineetauxEtats‐Unis(Kawashima,2014).
Lamaladieestégalementprésentedansplusieursautrespays
asiatiques.EnCoréeduSud,leKoreaRuralEconomicInstitute
(KREI),estimeque19%desélevagesdeporcsdeCoréeduSud
ontconnuunépisodedeDEPréduisantlaproductionen
porceletsdecesélevagesdeprèsde25%.Lesvirusidentifiés
danslesfoyersdeDEPdepuisNovembre2013affichent99,9%
d’identitéavecdessouchesnord‐américaines(Choietal.,
2014).AuVietnam,desfoyersémergentsdeDEPontété
confirmésdèsledébut2009pardesexamensnécropsiqueset
laréalisationdeRT‐PCRdanslaplupartdesprovincesduSud
Vietnam(Doetal.,2011).
1.3. EnEurope
EnEurope,lespremierscasdeDEPdatentde1971au
Royaume‐Uni(Oldham,1972).Lamaladies’estensuite
étendueàplusieurspaysenEurope.Danslesannées1980,des
enquêtessérologiquesconduitesdansplusieurspays
européens(Belgique,Allemagne,France,Espagne,Pays‐Bas,
Royaume‐Uni,Suisse,Bulgarie)ontmontrélatrèslarge
diffusionduvirusdanslapopulationporcine.
2015. Journées Recherche Porcine, 47.
260

Apartirdesannées1990,laprévalenceduvirusadéclinédans
cespays(PensaertandVanReeth,1998)aveccependant
quelquescassporadiquesjusqu'àlafindesannées1990.
LescasdécritsenEuropedanslesannées1990contrastaient
avecceuxdecertainspaysd’Asieoùl’onobservaitplutôtdes
épizootiessévèresassociéesàdetrèsfortstauxdemortalité
(Japon,CoréeduSud).Depuis,ladernièreépizootiedeDEP
décriteenEuropedataitdemai2005àjuin2006danslavallée
duPôauNorddel’Italie(Martellietal.,2008).Lesélevages
affectés(63autotal)étaientaussibiendesélevagesnaisseurs‐
engraisseursqu’engraisseurs.Letauxdemortalitémaximal
atteintétaitde34%.Lecaractèreépizootiquedesfoyers
suggéraitquel’immunitédesanimauxétaitfaiblevoire
absentemaisquelevirusdelaDEPpouvaitencorecirculerà
basbruit.Eneffet,desépisodesdeDEPontdenouveauété
rapportésde2008à2014enItalie(73casautotaldans
60élevages)(Sozzietal.,2014).Uneétudedeséroprévalence
réaliséesurdessérumsprélevésen2014révèleque
11élevagessur21avaientdesanimauxséropositifspourle
vDEPavecdestauxdeprévalencevariantde6,7%à52%.
LesséquencespartiellesdugèneSmontrentquelessouches
de2007à2009sontgénétiquementprochesainsiquecelles
isoléesde2009à2012.Parcontre,lesdeuxsouchesde2014
sontplusprochesgénétiquementdessouchesdetype
«InDel»isoléesauxEtats‐Unis.LevDEPcontinuedoncde
circulerenItalie.
UneétudedeséroprévalenceréaliséeauRoyaume‐Uniamis
enévidence9%d’animauxséropositifs,àpartirde558sérums
prélevéssurdesporcsàl’abattoir(Armstrong,2014).
EnFrance,dessérumsdetruiescollectésen2014ontété
testéspourlaprésenced’anticorpsanti‐vDEP.Lafréquencede
truiesséropositivesestde3,6%auniveauindividuel(Grasland
etal.,2014a;Graslandetal.,2014b).EnAllemagne,descasde
DEPontétérécemmentdécritsaucoursdudébutdel’été
2014dansdesélevagesengraisseurs(HennigerandSchwarz,
2014).Lessouchesisoléessontprochesgénétiquementdes
souchesmoinsvirulentesrécemmentdécritesauxUSA.
2. PHYSIO‐PATHOLOGIE
2.1. Signescliniquesetlésions
LeprincipalsignecliniquedelaDEPestunediarrhéeliquide
parfoisprécédéedevomissements.Chezlesanimauxadultes,
l’infectionpeuttoutefoisêtresub‐cliniqueouprovoquer
uniquementdessignesd’anorexieetdevomissement.
Lorsd’épizootie,lestauxdemortalitépeuventvarierde50%
enmoyennejusqu’à95‐100%chezlesporceletssouslamère,
commelorsdel’épizootiequisévitactuellementenAmérique
duNord.Lesporceletssouslamèreprésententdessignes
cliniquesdansles24‐48haprèsl’infectionetcependant3à4
joursavantdemourir.Lesanimauxplusâgésrécupèrentune
semaineaprèsl’apparitiondessignescliniques.Laduréed’une
primo‐infectiondansunélevageduredetroisàdixsemainesà
l’échelondel’élevage.Leslésionsmacroscopiquesontété
décriteschezdesanimauxnaturellementou
expérimentalementinfectés(Coussementetal.,1982;
Ducatelleetal.,1982;Jungetal.,2014;Pospischiletal.,
1982).
Lesmacro‐lésionsseconcentrentauniveaudel’intestingrêle
petitintestin,dontlaparoidevientfineettransparenteet
dontlecontenuestaqueuxetdecouleurjaunâtre(Stevenson
etal.,2013).
2.2. Reproductionexpérimentaledelamaladie
LaDEPapuêtrereproduiteexpérimentalementpeudetemps
aprèsl’identificationdel’agentcausal,surdesporceletsâgés
dedeuxàdix‐huitjoursetinoculésparvoieoraleavecla
soucheeuropéenneCV777maiségalementchezdesporcsen
engraissement(Deboucketal.,1981).Lesporceletsont
présentérapidementdessignescliniquesentre22à36haprès
inoculation.Laréplicationduvirusaalorsétédémontréedans
lescellulesépithélialesdesvillositésdupetitintestindès12h
post‐inoculation,maiségalementauniveauducôlon.Des
résultatssimilairesontétéobtenusavecunesouche
américaineisoléeenjuin2013(Jungetal.,2014).Des
porceletsâgésdedixàtrente‐cinqjoursontétéinoculéspar
voieoro‐nasaleouoraleavec106,3à109copieséquivalent‐
génome.Lesporceletsontcommencéàexcréterlevirusdans
lesfècesdès24hpost‐inoculationettouslesporceletsont
montrédessignescliniquessévèresdediarrhée.Levirusaété
détectédanslatotalitédel’intestin,lejéjunumetl’iléonétant
lespremierssitesd’infection.Touslesanimauxontégalement
présentéunevirémiejusqu’à107,6copieséquivalentesau
génome/mLdesangaprèsl’apparitiondessignescliniques.
LesanticorpscontrelevDEPsontdétectésentredeuxàtrois
semainesaprèsinfectionetpeuventpersisterplusdedeux
ans.Cependantlaprésenced’anticorpssériquesn’estpasune
preuvedeprotection.Laprotectionvis‐à‐visd’uneréinfection
estplutôtreflétéeparlaprésenced’uneimmunitémucosale
intestinalequiest,elle,decourtedurée(Pensaert,1989).Les
porceletssontprotégésparlesanticorpsmaternelsprésents
danslecolostrumjusqu’àl’âgedequatreàtreizejours,la
duréedel’immunitédépendantdutitresérologiquedela
mère(SongetPark,2012).Aprèsuneprimo‐infection,des
réinfectionspériodiquessontdécritesdanscertainsélevages
(DufresneandRobbins,2014)etpeuventavoirlieudèscinq
moisaprèslepremierépisodedeDEPetce,enprésence
d’anticorpschezlesanimaux(Pensaert,1989).
Afindedéterminerladoseminimaleinfectanteavecune
souchedevDEPisoléeauxEtats‐Unisen2013,desdilutionsen
sériede10en10ontétéréaliséesàpartird’unhomogénat
clarifiédemuqueusesd’intestinprélevéessurunporcelet
affectéparlaDEP.Cesdilutionsontensuiteétéinoculéespar
voieoro‐nasaleàdesporceletsdedixjours.Dessignes
cliniquesdediarrhéeontétéobservéschezlesporceletsayant
reçulesdilutions10‐2à10‐8.Aucunsignecliniquen’aété
relevéchezlesanimauxinoculésaveclesdilutions10‐9à10‐12.
Cesrésultatsindiquentqueladoseinfectieuseminimaledu
vDEPesttrèsfaible(Goyal,2014).Deplus,dansl’étudede
reproductionexpérimentaledelamaladieoùlesanimaux
excrétaientduvirusdès24hpost‐inoculation,unporcelet
avaitétémisencontactindirectavecuncongénèreinoculé
parvoieoro‐nasale.Ceporceletaprésentédessignes
cliniques2haprèsl’apparitiondessignescliniquesdel’animal
inoculé(soit48haprèsl’inoculation)etlesmêmescharges
génomiquesdanslesfècesetsérum.Cesrésultatsdémontrent
unetransmissionhorizontaledeporcàporctrèsefficace.
3. VIRUSDELADEP
3.1. Agentstructural
LevDEPestuncoronavirus,classédanslegenre
alphacoronavirus.Ils’agitd’unvirusenveloppéàARNpositif,
simplebrinde28kbenviron.
2015. Journées Recherche Porcine, 47.
261

Levirusn’infectepasl’homme.Ilpeutêtrecultivéinvitrosur
descellulesvero(cellulesdereindesingevertafricain)en
présencedetrypsinedanslemilieudeculture.Ilreste
néanmoinsdifficileacultiver(SongetPark,2012).
Legénomeviralprésentelastructurecommuneàtousles
coronavirus.Unecoiffeen5’etunequeuepolyAen3’.L’ordre
desgènesestdansl’ordrecanoniqueretrouvécheztousles
coronavirus:réplicase‐S‐E‐M‐N.Laréplicaseestcodéepar
deuxORF,1aet1b.LegèneScodepourlaprotéinedespicule
àlasurfaceduvirionquiestlaprotéinelaplusimmunogène
duvirus.LegèneEcodepourlaprotéined’enveloppe,legène
MpourlaprotéinedematriceetlegèneNpourla
nucléocapsidequientoureetprotègel’ARNviral(Masters,
2006).LevDEPprésenteunORFsupplémentaireappeléORF3,
situéentrelegèneSetE.Paranalysephylogénétique,ense
basantsurlesséquencesdesgènesS,MetORF3,ilest
possibled’identifierdifférentsclustersselonlarégion
d’origine.EnAsie(Chine,CoréeduSud,Vietnam)etauxUSA,
lessoucheshypervirulentesdevDEPontétéidentifiéesetce,
malgrél’utilisationdevaccinsinactivésouatténuésavecla
soucheCV777enChineouDR13enCorée.AuxUSA,deux
typesdesouchesdevDEPcirculentactuellement,lessouches
hypervirulentesidentifiéesdèslespremierscasenavril2013
(Huangetal.,2013;Stevensonetal.,2013)etcelles
dénommées«InDel»présentantunedélétionpuisune
insertiondenucléotidesaudébutdugèneS(Okaetal.,2014;
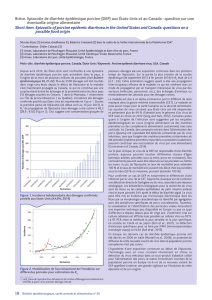
Wangetal.,2014)(Figure2).
83p -5 (A B54 861 8) (0. 0 021)
AttDR 13(J Q023 162 ) (0. 00 06)
A
tt en uated v acci ne(K C1899 44) ( 0. 000 8)
SD -M( JX5607 61) ( 0. 000 4)
JS2 008( KC109 141) (0.00 09)
MK(A B5 4862 4) ( 0. 0147 )
B
r1/ 87(Z254 83 ) (0 .0 009)
CV777(AF353511
)
(0 .0 001 )
LZC(EF 1859 92) ( 0.0054
)
SM98(GU9 3779 7) (0 . 0036 )
D R1 3(J Q023 161) (0.00 29
)
CH/S/1986(JN547228) (0.0190)
CH -G M
B
-0
2
-201 3(K C7 875 39) ( 0.0040
)
CH-HK
C
-08 -20 11(J X2 424 62) ( 0.001 5)
CH-ST
C
-12 -20 12(K C7 875 43) ( 0.004 2)
CH/F JX
M
-2
/
20 12(J X0 706 72) ( 0.003 9)
C H/HB QX /10( JX 5013 18) ( 0.001 8
)
OH851(KJ3 99978) (0. 00 21)
JS 1201 03( KF4 5351 3) (0 .0050 )
CH-SH
T
- 12 -2011 (JX 24 2464 ) (0.0 073)
CH13 -GX( JQ9 792 88) ( 0.000 5)
CH2
2
-J S(JQ97 9290 ) (0.0 009)
CH/JLGZ U/20 11(J Q63 8923) (0 .0 055)
JS -20 0
4
-2( AY 6532 04) (0 .0 036)
LJ B/0 3(DQ 9857 39) ( 0. 014 2)
KH( AB548 622 ) (0. 02 54)
NK( AB548 623) (0. 01 95)
A D03( KC879 282) (0. 01 75)
KNU -09 02( GU1 801 45) (0 .010 3)
NPP ED01 08_1( KC76 4953 ) (0. 0 094)
CH/ FJND -3 (JQ 2829 09) ( 0. 012 1
)
A
J 110 2(J X18 845 4) (0 .0 004)
LC (JX 489 155 ) (0.00 00)
CHGD(J
X
261936) (0.0015)
GD -1(J X6 4784 7) (0 .0005 )
GD-A (JX11 2709 ) (0. 0 000)
CH/FJZ
Z
-9 (KC 140 102 ) (0.00 56)
Z JCZ4( JX5241 37) (0. 001 1
)
Z J12 1030 (KF 7382 64) ( 0.005 9)
AH 2012 (KC210 145 ) (0. 00 34)
B
J
- 2011 - 1(J N8257 12) (0.000 9
)
CH/ XCYL/1 1(J X50 132 3) (0 .0 029)
J
S
-HZ2 012( KC21 0147 ) (0 .0 003)
GD-B(JX088695) (0.0016
)
S D130 502( KF7 382 61) ( 0. 0038 )
CH/ZMDZY/11(KC196276) (0.0045)
CO (KF 272920) (0. 00 00)
IA2(KF468753
)
(0.0002)
IA3(KF452322
)
(0 .0026 )
IA1(KF468754) (0 .0 005 )
Indiana(KF452323) (0 .0 000)
M N1(KF 468752) (0 .0 005)
OH1414(KJ408801) (0.00 07)
Souches
hypervirulente
s
USA
–
04/2013
1
2
Souche
européenn
e
deréférence
Souche«
InDel »
USA‐ 12/2013
Figure2–Arbrephylogénétiquebasésurlaséquence
nucléotidiquedugèneSde53souchesdevDEP
(adaptédeWangetal.,2014)
3.2. Transmissionduvirus
3.2.1. Transmissionoro‐fécaleetaérienne
LevDEPsetransmetessentiellementparvoieoro‐fécaleentre
porcs.
L’épizootieauseind’unélevagesensiblesurvientquatreàcinq
joursaprèsl’introductionoulaventedeporcs.Levirusest
ainsiprobablementintroduitenélevageviadesporcsinfectés
oupartransportmécanique(bottes,camions,etc.),d’où
l’importancedesmesuresdebiosécuritéetd’hygiènedansla
préventiondel’introductionduvirusenélevage.Levirusest
susceptibledepersisterplusfacilementsousuneforme
enzootiqueauseindel’élevageaprèsunepremièrephase
épizootique.Uncycleenzootiquepeutainsis’instaurerdans
lesélevagespratiquantunrythmederotationimportantet
desmélangesdeportéesissuesdebandesdifférentesetde
statutimmunitairehétérogène.
Uneétudedetransmissionduvirusparvoieaérienneaété
réalisée.DesporceletsontétéinfectésparlevDEP.Des
prélèvementsd’airontétéréaliséspendantlestroispremiers
jourssuivantl’infectiondanslessalleshébergeantlesanimaux
etsesontrévéléspositifspourladétectiondugénomeviral.
Desanimauxontensuiteétéinoculésaveclesprélèvements
d’airpositifsdiluésetontprésentédessignescliniquesetdes
lésionsdeDEP,indiquantquelevDEPprésentdansles
prélèvementsd’airétaitinfectieux.Uneautrepartiedecette
étudeamontréquedesprélèvementsd’airréalisésàplusde
16kmd’unélevageaffectéparlaDEPétaientpositifspourla
présencedegénomeviralsansquelecaractèreinfectieuxdes
prélèvementsn’aitpuêtredémontré(Alonsoetal.,2014).
Cetteétudesuggèrequelavoieaériennepeutcontribueràla
disséminationduvDEP.
3.2.2. Transmissionparlasemence
Latransmissionduvirusparvoievénériennen’estpasconnue
àl’heureactuelle.Elleestnéanmoinspossiblepuisqu’une
phasedevirémieestobservéeaumoinslorsdeprimo‐
infection.Cettehypothèseestégalementsupportéeparla
détectiondegénomeviraldanslessemencesprovenantde
verratsinfectésprésentsdansuncentred’insémination
artificielleaffectéparlaDEP(DufresneetRobbins,2014).
Cependantcetteobservationpourraitaussirésulterd’une
contaminationcroiséepardesfèceslorsdelacollecteoula
préparationdelasemence.
3.2.3. Transmissionparvoiealimentaire
L’agencecanadiennedel’inspectionalimentaire(Canadian
FoodInspectionAgency(CFIA))aannoncéenfévrier2014que
del’ARNduvirusdeDEPavaitétédétectédansdes
échantillonsdeplasmadeporcenprovenancedesEtats‐Unis
etentrantdanslacompositiond’alimentporceletpremierâge.
L’agencecanadienneaalorsémisl’hypothèseque
l’alimentationpouvaitcontribueràvéhiculerlevirus.Unbio‐
essaiaensuiteétéréaliséaucoursduqueldesporcelets
inoculésavecduplasmapositifenRT‐PCRpourlaprésencede
vDEPontprésentédessignescliniquesdeDEP.Parcontre,
lorsquelesgranulésutilisésenalimentation(del’ordrede5à
10%deplasmaincorporédansl’aliment)ontétédistribuésaux
porcelets,aucunanimaln’aprésentéd’infectionparlevDEP
(Pasicketal.,2014).Lesenquêtesréaliséesparlasuiteen
Ontario,Canada,surlespremiersélevagesaffectésparlaDEP
montrentquedix‐huitdesvingtpremiersélevagesconcernés
étaientlivrésparlamêmeusined’aliments;celaétait
égalementlecaspourl’élevageatteintdeDEPsituésurl’îledu
PrinceEdouard.Uneautreétudeayantutilisédesplasmas
positifspourlaprésencedegénomedevDEPincorporédans
desgranuléspouralimenterdesporceletsn’apaspermisde
reproduirelamaladie(Opriessnigetal.,2014).
LapossibilitédetransmissionduvDEPparvoiealimentairea
étédémontréeparunessaiexpérimental(Deeetal.,2014).
2015. Journées Recherche Porcine, 47.
262

Dansdesélevagesayantdestruiesprésentantdessignes
cliniquesdeDEPdansles24à48haprèslalivraisond’aliments,
desprélèvementsontétéeffectués,àl’aidedechiffonnettes
etderouleaux,danslessilosstockantl’aliment.L’ARNvirala
puêtremisenévidencedansceséchantillons,montrantque
l’alimentpouvaitêtrecontaminéparlevirus.L’alimentstocké
danslessilosetpositifpourlaprésencedevDEPaétémélangé
àdel’alimentindemnedevirusetutiliséenlibreaccèspour
nourrirdesporceletsenanimalerieconfinée.Lesporceletsont
développédessignescliniquesdediarrhéeetvomissement
quatrejoursaprèsl’ingestiond’aliment.Cestravauxmontrent
quel’alimentpeutêtreunvéhiculed’introductionduvDEP
dansdesélevagesindemnes.
3.3. Résistanceduvirus
LevDEPeststabledansunegammedepH5à9à4°cetdeHh
6,5à7,5à37°c(Pospischiletal.,2002).Leviruspeutsurvivre
dansdesconditionsdepHassezlargesàtempératurebasse.
Eneffet,lesépizootiesdeDEPsontpluslargementobservées
enhiver.Lesdésinfectantsefficacesvis‐à‐visduvDEPsont
ceuxcontenantduphénol,duperoxygène,duchloreetceux
contenantdel’ammoniumquaternaireetduglutaraldéhyde.
Demême,larésistanceduvirusàdifférentstraitementsde
tempsetdetempératureaététestéeenutilisantune
suspensiondelisiercontaminéedéposéesurunsupport
métallique,traitéepuisprélevéepourinoculerdesporcelets.
Seulslestraitementsà71°cpendantdixminutesetà20°c
pendantseptjoursontpermisd’éviterl’infectiondeporcelets.
Parcontre,lestraitementsde54ou62°cpendantdixminutes,
de37°cpendant12houde20°cpendant24h,n’ontpaspermis
d’éliminerlevirusinfectieux.
4. EVALUATIONDURISQUED’INTRODUCTIONEN
FRANCE
LaDirectionGénéraledel’alimentationasaisil’Ansesenavril
puisenmai2014pourévaluer1)lerisqued’introductiondu
vDEPenFrance,2)lerisquedesadiffusions’ilétaitintroduit,
et3)pourapporterdesréponsessurlapertinencede
différentesmesuresdegestion.
4.1. Risqued’introduction
Aprèsavoirévaluélesdifférentesvoiesd’introductionduvirus
etconsidérantladoseminimaleinfectanteextrêmementfaible
pourlevDEP,sarésistancedansl’environnementetla
quantitédevirusexcrétéeparlesanimauxmalades,lerisque
d’introductiondelaDEPenFrance,àpartird’unpaysinfecté,
estavéré.Leniveaudelaprobabilitéd’introductiondiffère
selonletypedeproduitconcerné.Ainsi,laprobabilité
d’introductionaétéévaluéeàunevaleurde6à7pourles
porcsvivantssuruneéchelleordinalede0à9
(0correspondantaurisquenulet9correspondantaurisque
trèsélevé).Unevaleurde6aétédonnéepourlesproduits
sanguins,etde5pourlessemences,embryons,matérielet
véhiculesagricoles.Ilconvientnéanmoinsdesoulignerque
cetteestimationdelaprobabilitéd’introductionduviruspar
lesembryonsestentachéed’uneincertitudeimportante,du
faitdumanquededonnéesdisponibles.Comptetenudes
caractéristiquesduvirus,lerisquedecontaminationcroisée
desproduitsparlevDEPprovenantdeproduitsdeporcsest
omniprésent.Laplusgrandevigilances’imposedoncencequi
concernel’originedetoutintrantenélevagedeporc(Anses,
2014).
4.2. Mesuresdecontrôle
L’analyseépidémiologiqueeffectuéeautraversd’unmodèle
depropagationinter‐troupeauduvDEPconduitàétablirun
scénariodediffusionrapidedelamaladieenl’absencede
mesuredegestion,notammentdansleszonesàfortedensité
porcine.Différentesmesuresdemaîtrisedeladiffusiondu
virusontétéévaluées.Ilressortque,pourlepremierfoyer,
unesimpleclaustrationdansunerégionàfortedensité
d’élevagenesuffiraitpasàempêcherlapropagationdela
maladiemaisaucontrairequ’unabattagetotal,associéà
l’applicationdemesuresdebiosécuritédrastiques,serait
davantageappropriépourtenterdelimiterlapropagation.
Ilestégalementestiméqueledélaideréactionestessentiel:
uneréactiontroptardive(longintervalleentreladétection,la
déclarationetlamiseenplacedelamesuredegestion,
40joursversus10jours)multiplieraitlesoccasionsde
disséminationduvirus,rendantinefficacel’abattagedece
premierfoyervis‐à‐visdelapropagationdelamaladie(Anses,
2014).
CONCLUSION
L’épizootiemajeuredeDEPquisévitactuellementdans
plusieurspartiesdumonde(Amérique,Asie)témoignedela
pathogénicitéélevéedenouveauxvariantsdevDEPisolésen
ChineetenAmériqueduNordainsiquedel’efficacitéetdela
rapiditédeleurtransmission.Lesdonnéesphysio‐
pathologiquessurcesnouveauxvariantsdevDEPmettenten
évidenceunepathogénicitébeaucoupplusimportanteque
celledesvirusdeDEPayantcirculéenEuropedanslesannées
1980oudeceuxidentifiésaprèsledébutdel’épizootieaux
USA.Lesdonnéesépidémiologiquesissuesdesdifférentspays
touchéssuggèrentunephaseinitialedecontaminationquasi‐
simultanéedeplusieursélevagesgéographiquementdistants
avec,danslecasduCanada,unlienépidémiologique
correspondantàuneoriginecommunedel’alimentationdes
porcsdespremiersélevagestouchés.Cescaractéristiquessont
àrelieràl’identificationavéréeduvirusdansdesplasmas
incorporésàl’alimentationdesporcsetauxparticularitésde
résistanceimportanteàdifférentstraitementsphysiques.
L’autreparticularitémajeuredecevirusestlatrèsfaibledose
infectieusenécessaireetunerésistanceaccrueàtempérature
basse,cequisuggèreunefacilitédetransportmécaniquedu
virus(camions,bottes,…)etexpliquelesdifficultés
rencontréesdanslamaîtrisedesapropagation,mêmedansun
contexted’applicationdemesuresd’hygièneetdebiosécurité
strictes.
AuregarddurisquedepropagationduvirusenFrance,laDEP
vientd'êtreajoutéeàlalistedesdangerssanitairesde
premièrecatégoriepourlesespècesanimales,faisantl'objet
d'uneémergence,enannexeI.bdel'arrêtédu29juillet2013.
Cettedécisionapourconséquencederendreobligatoirela
déclarationdetoutcasapparaissantsurlesolfrançais.
Encasd’introductionenFrance,seuleuneidentificationrapide
duoudespremierscaspermettralamiseenplacerapidede
mesuresdegestionassociéesàdesmesuresdebiosécurité
strictes,afindelimiterlapropagationdelamaladie.
2015. Journées Recherche Porcine, 47.
263
 6
6
1
/
6
100%