PROF : SALAH MOHAMED
1
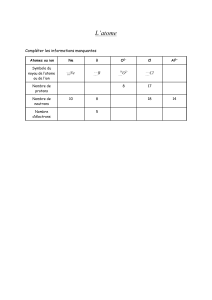
Niveau : 1èreannée secondaire Structure de la matière à l’échelle microscopique
I. Divisibilité de la matière
La matière est-elle divisible ? La matière existe sous trois états différents : solide, liquide, gazeux.
L'hypothèse de la divisibilité de la matière est-elle valable pour ces trois états ?
Expériences :
Nous allons envisager le cas de plusieurs solides : la craie, le sulfate de cuivre, le parfum, le fer
Craie
Sulfate de cuivre
Parfum
Fer
Prenons une craie et
écrivons au tableau,
ensuite écrasons-la.
Des particules de
craie restent sur le
tableau ; la craie
écrasée est réduite en
morceaux.
Dissolvons un peu de
sulfate de cuivre dans
l’eau, puis diluons la
solution.
La couleur de la solution
devient de plus en plus
claire
Le parfum sort du
pulvériseur sous forme
de gouttelettes très
fine et occupe tout le
volume de la classe.
Prenons une barre de fer
et limons-la
énergiquement au-dessus
d'un papier blanc. Nous
obtenons des grains de
fer
Conclusion :
La matière est divisible, mais cette divisibilité est limitée.
On dit que la matière est discontinue. Pour une substance
donnée,un corps pur donné, la plus petite particule que l’on puisse
concevoir sans détruire ce corps pur se nomme molécule.
• Les molécules ne sont pas toutes identiques.
• Des molécules identiques constituent un corps pur.
• Des molécules différentes constituent un mélange
Comportement microscopique selon l’état de la matière :
Structure moléculaire Structure moléculaire Structure moléculaire
Condensée et ordonnée condensée et désordonnée non condensée et désordonnée

PROF : SALAH MOHAMED
2
II- Dimension et masse d’une molécule
La molécule est une particule extrêmement petite, les dimensions d’une molécule sont de l’ordre de
quelques Angstrom (1Å=10-10m)
La masse d’une molécule est de l’ordre de 10-26Kg
III-L ’atome
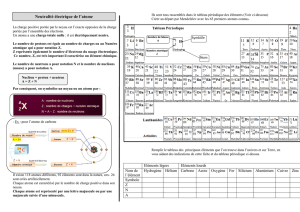
1. Définition
L’atome c’est la particule la plus petite constituant la matière.
2.Structure de l’atome
Un atome est constitué d’un noyau autour duquel gravitent des électrons.
Atomes du métal Or vus
au microscope électronique
Dimension de l’atome :
Un atome peut être assimilée à une sphère, Un atome a une taille de
l'ordre de 10-10m, soit un dixième de millionième de millimètre
Un noyau d'atome a une taille de l'ordre de 10-15m
soit cent mille fois plus petit que l'atome lui-même.
La masse de l’atome est pratiquement concentrée dans son noyau
Un électron est théoriquement une particule ponctuelle, elle ne doit donc pas avoir de taille... En tout
cas, si l'électron a une taille, elle est inférieure à 10-18m, soit au moins cent millions de fois plus petit
que l'atome.
Masse de l’atome :
La masse d’un atome est de l’ordre de 10-26 kg.
Exemples :
3.Les charges électriques dans l’atome
Chaque atome est caractérisé par le nombre des électrons noté Z.
Le numéro atomique Z est le nombre de charges positives dans son noyau, mais aussi le nombre
d’électrons dans l’atome.

PROF : SALAH MOHAMED
3
●Charge du noyau
Le noyau porte des charges électriques positives
Charge totale du noyau : Qn= +Z. e avec e est la charge élémentaire exprimé en coulomb e=1.6.10-19C
●Charge des électrons
Les électrons sont identiques quel que soit l'atome
Chaque électron porte une charge électrique négative notée -e
La charge électrique totale du nuage électronique (tous les électrons de l’atome) est Qe= -Z. e
●Charge de l’atome
L'atome étant électriquement neutre : Le nombre de charges positives du noyau est égal au nombre de
charges négatives des électrons, et on note :
Charge de l’atome : Qa = charge totale du noyau + charge totale des électrons
Qa = Qn + Qe = +Z. e + (-Z. e) = 0
VI-Symbole de l’atome et formule de la molécule
L’atome symbolisé par la première lettre de son nom latin et est écrit par une majuscule, parfois, une
deuxième lettre est ajoutée et est écrite en minuscule.
Les molécules sont des assemblages d’atomes, on les représente par une formule chimique qui contient
les symboles des atomes qui la constitue, puis nous ajoutons le nombre de chaque type d’atomes, à
droite et en bas de son symbole.

PROF : SALAH MOHAMED
4
V-Corps pur simple et corps pur composé
1.corps pur simple
Celui dont la molécule est constituée d'un même type d'atome.
Exemples : O2 - H2 - O3
2.corps pur compose
Celui dont la molécule est constituée d'atomes de types différents
Exemples : CO - NaCℓ - CH4
IV-Les ions
1.Définition
Un ion provient d'un atome ou d'un groupement d'atomes ayant perdu ou gagné un ou plusieurs
électrons.
Il existe deux types d'ions :
●Les ions positives proviennent d'un atome ou d'un groupement d'atomes ayant perdu un ou plusieurs
électrons, on les appelle cations.
●Les ions négatives proviennent d'un atome ou d'un groupement d'atomes ayant gagné un ou plusieurs
électrons, on les appelle anions.
●Un ion monoatomique est constitué d'un seul atome.
●Un ion polyatomique est constitué par un ensemble d'atomes.
Exemples :
1
/
4
100%