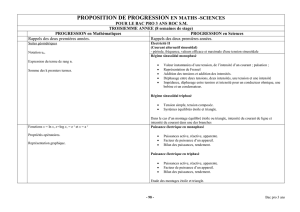
Tenue en service des matériaux
Dégradation des métaux
Les propriétés
des matériaux
LA CORROSION

Tenue en service des matériaux
Dégradation des métaux
*Quelques chiffres...
-aux Etats unis, ½ tonne d’acier est détruit à
chaque heure par la corrosion
-dans les pays industrialisés, le coût de la
corrosion s’élève à environ 4% du P.N.B.
*La dégradation dépend...
-du type de matériau
-de l’environnement dans lequel se trouve
ce matériau
Dégradation des métaux
(corrosion)

Tenue en service des matériaux
Dégradation des métaux
Exemples de corrosion des barres
d’armature métalliques dans le cas de
ponts.
La corrosion est grandement accélérée
par l’utilisation de sels de déglaçage

Tenue en service des matériaux
Dégradation des métaux
RAPPEL
Réaction d’oxydo-réduction
oxydation: MMn++ néanode
réduction: Mn++ né M cathode

Tenue en service des matériaux
Dégradation des métaux
Potentiel électrochimique
*Exemple
plonger deux métaux (Cu et Fe) dans une
solution acide
mesure d’une différence de
potentiel
électrolyte
électrodes
Eddp
d’où vient-elle ?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
1
/
35
100%