
COMMUNICATION
Données nouvelles dans l’imagerie du cartilage
Jean-Denis LAREDO *
RÉSUMÉ
On distingue deux types d’imagerie du cartilage. L’imagerie morphologique est utilisé dans
les soins courants et repose d’abord sur la radiographie qui montre l’espace articulaire,
image indirecte de l’épaisseur du cartilage, et doit rester l’examen de première intention car
peu coûteux, facilement accessible, reproductible, seul examen d’imagerie fait en charge et
qui peut être sensibilisé par une légère flexion (genou) ou une incidence particulière
(hanche). L’IRM n’est pas utile dans la grande majorité des cas mais peut permettre de
comprendre l’origine d’une douleur d’intensité disproportionnée par rapport aux images
radiographiques. C’est le seul examen qui donne une image directe de tous les composants
articulaires et montre « l’œdème » de l’os sous-chondral, très corrélé à la douleur. L’arthro-
scanner ou l’arthro-IRM sont nécessaires pour obtenir une image très fine du cartilage.
L’IRM structurale du cartilage, technique de recherche, permet d’appréhender les altéra-
tions de ses constituants, protéoglycanes ou collagène, avant même l’altération anatomique
et peut servir de marqueur dans la recherche sur les mécanismes de l’arthrose et l’évaluation
des futurs traitements.
SUMMARY
There are two different types of cartilage imaging modalities, which address either its
morphology or composition. Cartilage morphology is first indirectly assessed in clinical
practice using radiographs, which are still the first line examination due to its low cost,
availability, and reproducibility, as well as feasibility in the standing position and increased
sensitivity with specific patient positioning (fixed flexed knee radiograph and Lequesne view
for the hip). MRI is the only imaging examination, which can show all the joint components,
including the cartilage, the subchondral bone, and bone marrow lesions, which are highly
* Service de radiologie, Hôpital Lariboisière, 2 Rue Ambroise Paré, 75010 Paris.
Université Paris-Diderot et Laboratoire de recherches orthopédiques B2OA, UMR CNRS 7051
Tirés-à-part : Professeur Jean-Denis Laredo, même adresse
Article reçu le 14 février 2018, accepté le 26 février 2018
Bull. Acad. Natle Méd., 2018, 202,n
os
1-2, 153-171, séance du 27 février 2018
153

correlated with pain. However, MRI is not indicated in osteoarthritis unless the patient com-
plaints of dull pain unexplained at radiography. CT-Arthrography and MR-arthrography,
whichprovideadirectand detailed image of the cartilage, but require theintra-articularinjec-
tion of a contrast media, are indicated only when a very detailed image of the cartilage is
required. MRI may also address the cartilage composition with special acquisition sequences
providing a quantitative evaluation of the proteoglycans or collagen alterations, which occur
before the morphologic changes and which constitutes an advanced research tool to further
understand osteoarthritis pathogenesis and evaluate future treatments.
INTRODUCTION
On distingue deux types d’imagerie du cartilage : l’imagerie morphologique qui
permet d’observer les lésions macroscopiques du cartilage et l’imagerie structurale
(essentiellement en IRM) qui permet d’appréhender l’altération du cartilage avant
l’altération anatomique et peut servir de marqueur pour comprendre le mode
d’action des nouveaux traitements de l’arthrose [1]. Les modalités d’imagerie mor-
phologique sont nombreuses et complémentaires. Les avantages de la radiographie
sont son faible coût et sa simplicité. L’IRM est plus coûteuse mais donne une image
directe du cartilage. L’arthro-scanner et l’arthro-IRM donne une image très fine du
cartilagemaisnécessitent uneinjectionintra-articulairede contraste. À côtéde l’ima-
gerie morphologique du cartilage donnée par les radiographies, l’IRM, l’arthro-
scanner ou l’arthro-IRM, existe une imagerie IRM structurale/compositionnelle
du cartilage utilisée en recherche expérimentale et clinique qui permet de déceler les
altérations non seulement morphologiques mais aussi biochimiques du cartilage. En
effet, certaines séquences IRM d’excitation des protons d’hydrogène ou de sodium
permettent, spontanément ou après injection de gadolinium, de saisir des altéra-
tions de la charge hydrique et des principales protéines du cartilage, les glyco-amino-
glycanes (GAG) et le collagène. Cette imagerie qualitative n’est pas utile en pratique
courante mais est essentielle pour comprendre les phases initiales du développement
de l’arthrose et tester l’efficacité et le mode d’action des traitements médicamenteux
de l’arthrose dont nous espérons disposer dans les décennies futures. Dans ce texte,
nous commencerons par un bref rappel de l’anatomie du cartilage et de l’os
sous-chondral avant d’envisager l’intérêt de différentes modalités d’imagerie mor-
phologique puis l’imagerie structurale du cartilage articulaire.
Rappel anatomique et biomécanique
Le cartilage est un tissu composite, avasculaire et non innervé, qui est nourri par dif-
fusion de fluides. Il est principalement composé d’une matrice protéique extracellu-
laire riche en eau et de chondrocytes. Cette matrice protéique comporte elle-même
deux principales composantes, des fibres de collagène, de type II surtout, qui forment
l’armature du cartilage et vont lui permettre de supporter les contraintes mécaniques
et des GAG, glycoprotéines hydrophiles, qui assurent à la matrice une forte charge
hydrique et des qualités mécaniques qui protègent les fibres de collagène.
Bull. Acad. Natle Méd., 2018, 202,n
os
1-2, 153-171, séance du 27 février 2018
154

Le cartilage hyalin forme, avec l’os sous-chondral, une unité biomécanique trans-
mettant et amortissant les contraintes, tout en assurant la mobilité articulaire et en
prévenant les dégâts anatomiques. Le point de faiblesse d’une chaine mécanique
étant la zone de jonction entre des matériaux aux caractéristiques mécaniques très
différentes, cette unité est composée de quatre couches de tissus aux qualités
mécaniques qui varient progressivement et permettent d’assurer une progressivité
dans l’absorption des contraintes : os trabéculaire, lame corticale sous-chondrale,
cartilage calcifié, cartilage non calcifié.
La micro-architecture du cartilage hyalin est très différente selon la profondeur. Il
est organisé en couches où l’orientation des fibres de collagène et le contenu en
chondrocytes et en protéoglycanes sont très différents [2]. Dans la couche superfi-
cielle, l’orientation tangentielle des fibres, parallèles à la surface du cartilage, confère
au cartilage sa résistance aux forces de friction et de cisaillement. La zone basale est
constituée de fibres perpendiculaires à la surface du cartilage, ancrées dans la plaque
calcifiée et assurant ainsi l’amarrage du cartilage à l’os sous-chondral. La zone
intermédiaire est, quant à elle, constituée de fibres de collagène très incurvées,
arciformes, avec une organisation tridimensionnelle variable, contribuant à la dis-
persion des contraintes. En IRM, l’hétérogénéité du signal du cartilage sur des
séquences pondérées T2 ou protoniques utilisées en pratique clinique reflète la
variabilité organisationnelle des fibres de collagène.
Les protéoglycanes résultent de la combinaison d’un corps protéique sur laquelle se
fixent de longs sucres, chaînes de GAG chargées négativement. Cette densité de
charges négatives élevée (FCD, pour fixed charge density) permet la formation de
liaisons ioniques avec le sodium, chargé positivement. A son tour, l’accumulation de
sodium va retenir l’eau et déterminer une pression osmotique au sein du cartilage.
Le cartilage est ainsi constitué de 65 à 85 % d’eau.
L’IRM, qui est une imagerie des protons d’hydrogène et donc de l’eau, permet de
visualiser la charge hydrique du cartilage. Le stade précoce de l’arthrose est
caractérisé par une augmentation de la teneur en eau libre du cartilage au détriment
de l’eau liée à la matrice extracellulaire. Ce transfert est consécutif à la baisse de
la teneur du cartilage en GAG qui va entraîner une diminution de la FCD et
donc une diminution de l’eau liée aux GAG. Un aspect IRM en franc hypersignal T2
du cartilage est donc le témoin d’une augmentation de l’eau libre au détriment de
l’eau liée et la conséquence d’une altération de la matrice cartilagineuse.
Imagerie morphologique du cartilage en pratique clinique
En routine clinique, l’imagerie du cartilage repose sur les radiographies qui n’en
donnent qu’une image indirecte. En effet, le cartilage articulaire hyalin n’est pas
calcifié et absorbe très peu le rayonnement photonique. Il est donc « transparent »
en radiographie, et son épaisseur est appréciée de façon indirecte par la largeur de
l’espace, ou « interligne articulaire », délimité par les deux épiphyses osseuses.
Cependant, l’expression clinique de l’arthrose commune est habituellement en
Bull. Acad. Natle Méd., 2018, 202,n
os
1-2, 153-171, séance du 27 février 2018
155

retard sur les signes structuraux d’usure mécanique, si bien que l’évaluation
grossière de l’épaisseur du cartilage sur des radiographies successives est souvent
suffisante pour suivre l’évolution du pincement de l’interligne articulaire et poser,
le jour venu, l’indication d’un remplacement prothétique. Dans certains cas
cependant, l’aspect radiographique de l’articulation n’apporte pas d’explication
satisfaisante aux symptômes, soit que l’altération du cartilage hyalin échappe à la
radiographie parce qu’elle est localisée, soit qu’elle touche un fibrocartilage comme
les ménisques au genou ou le labrum glénoïdien ou acétabulaire, soit encore que
le degré d’arthrose sur les radiographies n’explique pas l’intensité ou la brutalité des
symptômes. Dans ces cas, il devient nécessaire d’obtenir une image directe du
cartilage articulaire. Dans les années 1950 à 1980, c’est l’arthrographie, radiographie
précédée d’une injection articulaire de produit de contraste iodé, qui permettait
de dessiner le contour des cartilages hyalin et fibreux. À la fin de la décennie 1970
est apparue la tomodensitométrie et il est devenu possible de coupler l’arthrographie
et une acquisition scanner : c’est l’arthro-scanner qui reste à ce jour l’un des deux
examens de référence pour l’étude du cartilage articulaire. L’apparition, au début
des années 1980, de l’imagerie par résonance magnétique nucléaire (IRM) a été une
véritable révolution. Elle permet de voir tous les constituants d’une articulation, os,
capsule articulaire, ligaments et synoviale, ménisques ainsi que, dans une certaine
mesure, le cartilage hyalin là où il est suffisamment épais. Une vision précise du
cartilage hyalin nécessite cependant de faire précéder l’examen IRM de l’injection
intra-articulaire d’un sel de gadolinium : c’est l’arthro-IRM qui est plus couram-
ment utilisée aux USA qu’en France où l’arthro-scanner garde la préférence,
notamment pour des raisons de facilité d’accès aux machines.
La radiographie
La radiographie reste l’examen radiologique de première ligne indispensable dans le
diagnostic d’arthrose. Elle permet de quantifier l’usure diffuse du cartilage articu-
laire qui se manifeste par un pincement de l’interligne articulaire et de rechercher les
modifications arthrosiques caractéristiques de l’os sous-chondral en zone de
contrainte maximale avec une densification de l’os trabéculaire et un épaississement
la lame compacte sous-chondrale. Elle peut être sensibilisée par une incidence
particulière comme le faux-profil comparatif (contre-faux profil) à la hanche,
beaucoup plus sensible que la radiographie de bassin de face debout dans le
diagnostic de coxarthrose précoce [3, 4] ou un positionnement particulier du patient
comme la radiographie de face du genou en incidence postéro-antérieure (figure 1)
et en position de « schuss » (légère flexion de 20 à 30 degrés). Les points forts de la
radiographie sont sa simplicité de réalisation et son universalité, son faible coût, sa
compacité, sa reproductibilité, sous réserve que les conditions d’acquisition soient
rigoureuses, et la possibilité de la réaliser en charge ce qui sensibilise la recherche
d’une arthrose des membres inférieurs et n’est pas possible en routine en IRM. Ses
points faibles sont de n’être qu’une méthode indirecte de visualisation du cartilage
Bull. Acad. Natle Méd., 2018, 202,n
os
1-2, 153-171, séance du 27 février 2018
156
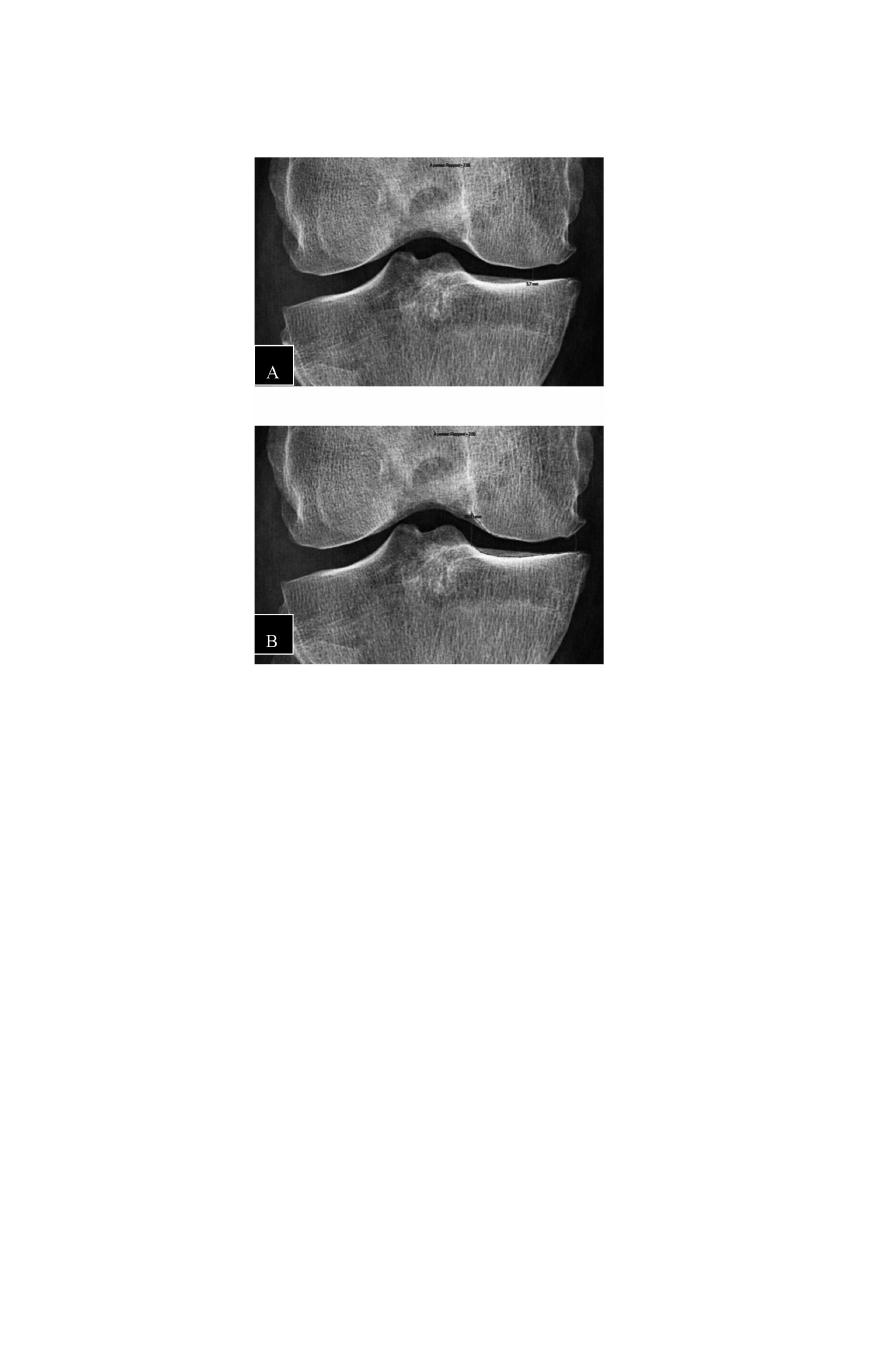
Fig. 1. — Mesure de l’interligne articulaire fémorotibial médial sur une radiographie du genou de
face en rectitude.
A : Mesure de l’épaisseur minimale de l’interligne fémorotibial médial délimité par les deux épiphy-
ses osseuses.
B : Mesure de la surface de l’interligne fémorotibial médial.
hyalin, de méconnaître les lésions cartilagineuses localisées et de globalement
sous-estimer l’importance des lésions. Elle ne montre pas les modifications de la
moelle osseuse et des tissus mous.
Arthro-scanner
Il consiste à faire précéder l’acquisition tomodensitométrique volumique d’une
injection intra-articulaire de produit de contraste qui va former un film à la surface
du cartilage et permettre de le visualiser de façon directe et volumique avec une
résolution spatiale quasi isotropique d’environ 500 microns. Il est utilisé en France
dans le bilan préopératoire de certaines arthroses et des dérangements intra-
articulaires. Il permet de cartographier finement l’étendue et la profondeur des
lésions cartilagineuses : fibrillation superficielle, fissures, ulcérations, amincisse-
ment, abrasion avec mise à nu de l’os sous-chondral dans les formes plus évoluées
(figure 2) [5, 6].
Bull. Acad. Natle Méd., 2018, 202,n
os
1-2, 153-171, séance du 27 février 2018
157
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%