2022
CHAPITRE 1: ATOMISTIQUES
REPRESENTED BY DR MARWA

Atome : qu'est-ce que c'est ?
1 DEFINITION
L'atome est le constituant fondamental de toute matière quel que soit sa état : gaz
solide ou bien liquide
A. CONSTITUTION DE L'ATOME
Un atome est constitué de particules chargées qui
se répartissent dans 2 parties :
UN NOYAU: Il est constitué de protons (de charge électrique positive),
et de neutrons (de charge électrique nulle). Ces particules, qui constituent
le noyau, sont également appelées nucléons.
UN CORTEGE ÉLECTRONIQUE: Il est constitué d'électrons (de charge
électrique négative) qui gravitent autour du noyau.
|La charge de l’électron |= la charge du proton = e = 1,6 10-10 C
Ca veut dire dans un atome, il y a autant de charges électriques négatives
(électrons) que de charges positives (noyau) donc l’atome est électriquement
neutre

! On note que la masse de protons et de neutrons est presque équivalentes tandis
que la masse de l'électron est beaucoup plus petite Alors l’essentiel de la masse
atomique est concentre dans celle de sons noyau puisque celle des électrons est
négligeable. Masse d’atome = Z (mp) +N (mn) +Z( mE)
Entre le noyau et les électrons, il y a du vide et tant que le noyau est très petit de
volume : on dit que la structure de l’atome est lacunaire.
B REPRESENTATION DE L’ATOME
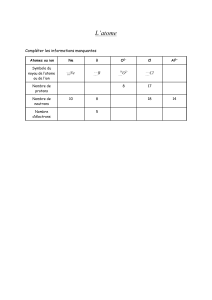
Un atome est représenté par le symbole :
A : Appelé le nombre de masse Il représente le nombre de protons Z et de neutrons N
A =Z + N avec A> ou =Z
Z : le numéro atomique =Le nombre de protons
On peut ainsi déduire que le nombre de neutrons = A-Z
q : est la charge totale portée par l’élément.
Pour dire un atome est neutre il faut que la somme des charges est nulle ( q = 0 )
le nombre d’électrons = le nombre de protons = Z

C. ISOTOPES
Lorsque deux atomes ont le même nombre de protons Z et sont différents par leur
nombre de masse A , ils sont considérés comme des isotopes.
Les isotopes sont alors différents seulement par leur nombre de neutrons.
Exemple :
les isotopes de l'hydrogène ::
- Ces trois isoptopes occupent tous la même place dans le tableau périodique.
D’ailleurs l’appellation isotope signifie en grec la même place ; isos : même et topos :
place
- L’oxygéne est un mélange composé de trois isotopes qui sont
L’abondance (ou le pourcentage %) et la masse de ces isotopes sont
différentes comme dans le tableau périodique on ne représente qu’une
seule case pour l’oxygène avec une seule valeur de la masse ! Que
représente cette masse ?
C’est une masse moyenne qui est en fonction de la masse Mi et de
l’abondance Ai de tous les isotopes
Cette masse moyenne est appelée aussi masse naturelle, masse du
mélange isotopique ou encore masse réelle.
D. Unité de masse atomique (uma) et masse molaire :
LE MOLE
En Chimie on regroupe les atomes par puiseque ils sont bq trops petits et
trop nombreux pour qu’on puisse les compter et ce paquet s’appele une
mole
Chaque mole contient 6,02.1023 atomes ,ce nombre appelé nombre
d’Avogadro NA
NA = 6,022.1023 mol-1
Un mole contient tjrs le même nombre d’atomes quelque soit l’atome

La masse d’une mole d’un élément est appelée masse molaire et notée M
Avec Mm = m/n
Mm=masse molaire [g/mol]
m= masse d’entités [g]
n= moles d’entités [mol]
Exemple : une mole de carbone 12C contient 6,022 1023 atomes de 12C et cette
quantité pèse 12,0000 g, donc la masse molaire du carbone 12C est 12 g/mol, on
écrit 𝑀12𝐶 = 12 g/mol
NA permet la conversion du nombre d’entités ( molecules,atomes, ions) en nombre
de mole et inversement Avec N=n*NA
Exemple
Calculer la masse d’un atome d’hélium 2𝐻𝑒 4 en uma et discuter les
résultats.
On convertit les masses des particules élémentaires en u
mp = 1,6726.10-27 kg = 1,007590 u
mn = 1,6749 10-27 kg = 1,008976 u
me-= 9,1095.10-31 kg = 0,000549 u
Un atome d’hélium contient : 2 protons, 2 neutrons et 2 électrons
Donc sa masse est égale :
 6
6
 7
7
 8
8
1
/
8
100%