Perfusion pulmonaire par
soustraction en angioscanner pour le
diagnostic d’embolie pulmonaire(EP)
Simon Coat1, Brieg Dissaux1,
Julien Ognard1,2, Jean-Christophe Gentric1,3,
Karim Haioun4, Pierre-Yves Le Roux3,5,
Michel Nonent1,3
1. Service de Radiologie, Hôpital de la Cavale Blanche, CHRU de Brest
2. LaTIM (Laboratoire de Traitement de l’Information Médicale, Inserm UMR 1101)
3. GETBO (Groupe d’Etude de la Thrombose de Bretagne Occidentale, EA 3878)
4. Canon MedicalSystemsFrance, CT division
5. Service de Médecine Nucléaire, CHRU de Brest

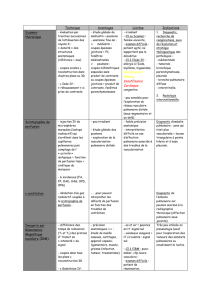
Introduction
•Les stratégies diagnostiques de l’embolie
pulmonaire (EP) reposent sur la probabilité
clinique, le dosage des D-dimères et les examens
d’imagerie
•Les techniques d’imagerie validées pour le
diagnostic d’EP sont la scintigraphie planaire et
l’angioscanner, rendant presque toujours inutile
le recours à l’angiographie pulmonaire
•Chacune de ces deux techniques présentent des
inconvénients, rendant utiles leur amélioration

Introduction
•La tomoscintigraphie permet d’améliorer les
performances diagnostiques de la
scintigraphie en permettant l’absence de
superposition, une meilleure localisation et
une meilleure caractérisation des lésions
•L’angioscanner est beaucoup plus souvent
conclusif que la scintigraphie mais est plus
irradiant et, contrairement à elle, n’apportait
pas jusqu’à récemment de renseignement sur
la perfusion pulmonaire
Bajc M et al : EANM guidelines for ventilation/perfusion scintigraphy : Part 1. Pulmonary imaging with ventilation/perfusion single photon
emission tomography. European Journal of Nuclear Medicine and Molecular Imaging 2009;36:1356-1370
Le Roux PY et al : Pulmonary scintigraphy for the Diagnosis of Acute Pulmonary Embolism : a survey of cirrent practices in Australia, Canada, and
France. Journal of Nuclear Medicine : official publication, Society of Nuclear Medicine 2009;50:1999-2007

Tomoscintigraphie pulmonaire
Embolie pulmonaire avec atteinte perfusionnelle estimée à environ 35 %
Ventilation
Perfusion

Perfusion pulmonaire et angioscanner
•L’angioscanner simple énergie est un examen de
routine pour le diagnostic d’EP, simple et robuste,
mais uniquement morphologique
•De nouvelles techniques d’angioscanner utilisant
la double énergie(DECT) et la soustraction sont
désormais disponibles
•Ces nouvelles techniques cherchent à analyser
l’état perfusionnel du poumon en une acquisition
en effectuant une Cartographie d’IODE (iodine
map)
–Ces techniques améliorent-elles les performances
diagnostiques?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%