Exercice 1: (2pts )
Choisir la (ou les) bonne(s) réponse(s) :
L’unité de la charge électrique dans le (S.I) est :
kilogramme «kg» mètre «m» litre «L» Volt «V»
La charge d’un électron est :
−1,6 × 10+19C 1,6 × 10−19C −1,6 × 10−19C −1,9 × 10−16C
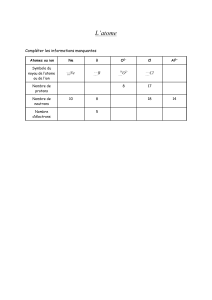
La particule non chargée dans l’atome est :
Le proton Le neutron L’électron
Les deux particules constituant le noyau d’un atome sont :
Le proton et l’électron Le proton et le neutron L’électron et le neutron
On représente symboliquement un noyau ou un atome par :
𝑋
𝐴
𝑍 𝑋
𝑍
𝑁 𝑋
𝑍
𝐴 𝑋𝑍
𝐴
Répondre par vrai ou faux :
Un atome est constitué d’un noyau entouré par des nucléons sous forme d’un nuage.
Pour un atome, le nombre d’électrons est égal au nombre de protons dans le noyau.
Le nombre de masse est noté Z.
Le nombre de masse est par définition égal au nombre de nucléons constituant le noyau.
Le nombre de neutrons dans un noyau est toujours égal au nombre de protons.
Le noyau du silicium représenté par 𝑆𝑖
14
28 contient :
14 protons 28 neutrons 14 électrons 28 nucléons
Exercice 2: (4pts )
Le noyau d’atome d’oxygène O contient 16 nucléons. Sa charge électrique est Qnoyau = + 8.e
Déterminer le numéro atomique Z de ce noyau, et déduire le nombre de neutrons N.
Calculer la charge électrique de ce noyau, et déduire la charge électrique du nuage électronique.
Donner le symbole de son noyau.
Calculer la valeur approchée de la masse de l'atome d’oxygène.
Donner la structure électronique de l’atome d’oxygène. Que peut-on dire sur sa couche externe ?
Dans la nature, il existe différents atomes d’oxygène 𝑶
𝟖
𝟏𝟔 , 𝑶
𝟖
𝟏𝟕 , 𝑶
𝟖
𝟏𝟖 . Que représentent ces atomes ?
L’atome d’oxygène se transforme en un ion en gagnant 2 électrons.
a. Donner le type et le symbole de cet ion.
b. Donner la charge électrique de cet ion en fonction de la charge élémentaire e.
c. Donner la structure électronique de cet ion. Que peut-on dire sur sa couche externe ?
Données : La masse du proton mp = mn = 1,7.10-27 kg, la charge élémentaire : e = 1,6.10-19 C
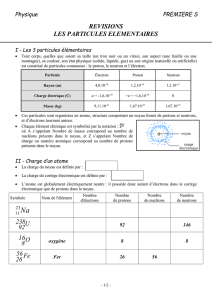
Exercice 3: (4pts )
Ion
Atome
Charge
de l’ion
Z
A
N
Nombre
d’électrons
Structure
électronique
Hydrogène
H+
1
1
Oxyde
………………
-2e
16
10
Potassium
………………
19
39
18
Groupe
scolaire AZ
Mini Test
Nom et Prénom :
………………………………………
Classe : T.C.S-A-
Durée : 1h15min
La note finale :
………………………….
Prof : FLYH Mohamed

Calcium
………………
40
20
18
Bromure
………………
Br
35
80
-e
Fer III
……………
26
30
Magnésium
Mg2+
12
24
Zinc
……………
+2e
30
64
Iodure
……………
𝐼
53
127
54
Manganèse
Mn2+
25
55
Lithium
Li+
3
7
Sodium
Na+
11
23
Chrome
𝐶𝑟3+
24
52
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
1
/
2
100%