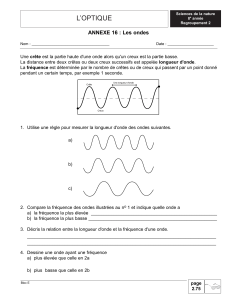
PHYSIQUE : CD et autres supports d’information
1. Le Compact-Disc.
1.1. La surface utile est égale à la surface occupée par la piste métallique, soit la surface totale du disque moins la surface
« centrale » : S = π.R22 – π.R12 = π.(R22 – R12)
1.2. L
S
a
2 2
2 1
.( )
R R
a
, d’après le document 1, le pas a de la spirale vaut 1,6 µm.
L
2 2
6
.((6,0 10 )² (2,5 10 )²)
1,6 10
≈ 5,8 × 103 m ≈ 5,8 km
1.3. La vitesse linéaire de défilement des informations gravées sur la piste est constante et égale à V = 1,2 m.s-1.
V =
L
t
donc Δt =
L
V
(calcul effectué avec L non arrondie) Δt =
3
3
5,841 10
4,9 10 s 81 min
1,2
durée théorique totale de lecture du CD
1.4.1. L’onde qui se réfléchit au fond d’un creux parcourt une distance supplémentaire δ = 2hc par rapport à l’onde qui se réfléchit
sur un plat. δ = 2 × 0,12×10–6 = 0,24×10–6 = 2,4×10–7 m
1.4.2. Dans le polycarbonate la lumière se propage à la célérité v = 1,93×108 m.s-1 (cf. doc. 2). Le retard est tel que v =
2
c
h
et
=
2
c
h
v
et d’après le doc 2, on a 2hc =
2
ainsi = 2
2
v v
soit =
9
8
503 10
2 1,93 10
= 1,3×10–15 s
1.4.3. Période de l’onde émise par le laser : λ = v.T donc T =
v
Et par suite =
2
v
, donc =
2
T
.
1.4.4. Les interférences sont destructives si le retard entre les deux ondes est :
= (2k+1).
2
T
Si on considère k = 0, alors =
2
T
,
ce qui correspond à la situation rencontrée ici. L’onde réfléchie par un creux et l’onde réfléchie par un plat interfèrent de façon
destructive.
1.4.5. Le signal reçu par le capteur est minimal. Les ondes sont en opposition de phase.
2. Le Blu-ray.
2.1. Ici, la longueur d’onde dans le polycarbonate vaut λ = 261 nm. Or 2hc =
2
donc hc =
4
=
261
4
= 65,3 nm profondeur d’un
creux sur un disque Blu-ray
2.2. La longueur d’onde du lecteur de CD n’est pas adaptée à la profondeur des creux du Blu-ray. Dès lors les interférences ne
pourraient pas se produire. Par ailleurs, le faisceau du laser serait trop large pour lire une seule piste du Blu-ray à la fois.
2.3. Pour le Blu-ray, la longueur de la piste est LBlu = 27 km tandis que l’on a déterminé au 1.2. une longueur de piste pour le CD de
L = 5,8 km. La capacité de stockage est proportionnelle à la longueur de la piste. Si elle est de 700 Mo pour le CD elle devrait être
de 700 x (27/5,8) = 3259 Mo. Cette valeur est bien inférieure à la capacité annoncée de 25 Go dans le tableau. On en conclut que le
codage de l’information sur le Blu-ray n’est pas basé sur le standard EFM.
T
le
S
pé
-
Physique Chimie
DEVOIR MAISON FACULTATIF Vacances Toussaint
Onde réfléchie
par un plat
Onde réfléchie par
le creux
Onde reçue par le
capteur
CHIMIE : Acide-base et Contrôle de qualité
Exercice 1. pH d’un milieu biologique
1. Définition d’un acide.
2. Calcul de la concentration : f = 50 donc [H3O+] = 0,1 mol/L soit pH = 1
3. Définition réaction acide-base. L’équation de la réaction entre l’acide carbonique et l’eau : H2CO3 + H2O HCO3- + H3O+
4. Le dioxyde de carbone entraîne l’apparition des ions oxonium lors de sa réaction acide-base avec l’eau : le pH va diminuer. Cependant, il peut
devenir trop acide si l’injection n’est pas régulée : méthode déconseillée à un amateur.
5. L’ion HCO3- est une espèce amphotère : elle peut jouer à la fois le rôle d’acide et de base.
6. On calcule la quantité de matière d’ions carbonate libérés par la dissolution du morceau de craie : n = m / M = 0,025 mol
On connaît la quantité de matière des ions oxonium : n = 10-3 x 100 = 0,1 mol
A la fin de la réaction cette quantité de matière sera donc n = 0,1 – 0,025 = 0,075 mol
On conclut par le calcul de la concentration en ions oxonium puis du pH : pH = 3,12. Le pH ne devient donc pas neutre.
7. Le pH de l’eau de l’aquarium ne reste pas stable au cours de la journée en raison de la respiration des plantes et des poissons, mais également si
la nourriture versée possède des propriétés acide-base.
Exercice 2. Dosage de la caféine
1. Définition du mot dosage en chimie. Principe d’un dosage par étalonnage.
2. Protocole de dilution par 2
3. Loi de Beer-Lambert.
4. Par lecture graphique, on détermine que Cm1 = 29 mg/L et Cm2 = 9,5 mg/L : le café le plus excitant est le numéro 1.
Exercice 3. Croissance des micros-algues
1. Méthode du titrage colorimétrique.
2. Le réactif titrant est le diiode I2, le réactif titré est l’ion chlorure Cl-
3. Définition équivalence d’un titrage.
Calcul de la concentration molaire en ions chlorure de la solution titrée : C = C’.Véq / Vi = 0,0575 mol/L
La solution titrée est de l’eau de mer diluée dix fois : C0 = 0,575 mol/L
En déduire la concentration massique : Cm = C0 . M = 33,6 g/L
4. On connaît la masse à atteindre pour 1 litre d’eau de mer, on en déduit la masse à ajouter : m = 106 – 33,6 = 72,4 g
Exercice 4. Contrôle de qualité
1. Equation-bilan de la réaction support du titrage : NH4+ +HO- NH3 + H2O
2. Schéma du montage expérimental d’un titrage par suivi pH-métrique.
3. Lecture du Volume équivalent par la méthode des tangentes.
4. Calcul de la concentration molaire de la solution titrée : C = C’.Véq / Vi = 0,0025 mol/L
On calcule la concentration massique : Cm = 0,14 g/L puis la masse dans le volume total de la fiole jaugée : m = 0,034 grammes.
En déduire la teneur massique en chlorure d’ammonium du bonbon. (masse introduite : 1,0 g) % m = 3,34 %
5. A l’aide d’un tableau d’avancement, on détermine la quantité de matière des espèces ioniques présentes à l’équivalence :
[Cl-] = 0,0025 mol/L et [Na+] = 0,002 mol/L
On calcule la conductivité σ = λNa+ . [Na+] + λCl- . [Cl-] = 0,029 S/m
1
/
1
100%