Modèle fonctionnel
du diaphragme pour l’acquisition et le
diagnostic en imagerie médicale
Laboratoire TIMC-IMAG, é
q
ui
p
e GMCAO
Responsable de stage : Emmanuel Promayon
Lynda Gaillard
Rapport de stage
Master Ingénieries pour la Santé et le Médicament (DEA MIMB) – 2002/2003

TABLE DES MATIERES
REMERCIEMENTS ................................................................................................... 4
1) INTRODUCTION ................................................................................................... 7
2) CONTEXTE – OBJECTIFS (CAHIER DES CHARGES) ........................................ 8
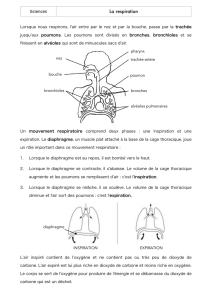
2.1) Le diaphragme ............................................................................................................................... 8
2.1.1) Anatomie du diaphragme.......................................................................................................... 8
2.1.2) Fonction du diaphragme ......................................................................................................... 10
2.2) Imagerie et modélisation du diaphragme .................................................................................. 11
2.2.1) Techniques d’imagerie............................................................................................................ 11
2.2.2) Problématique......................................................................................................................... 12
2.2.3) Modèles du diaphragme existants........................................................................................... 12
2.3) Objectifs du stage / Cahier des charges...................................................................................... 13
3) REALISATION D’UN MODELE TRI-DIMENSIONNEL DU DIAPHRAGME ..... 13
3.1) Matériel utilisé.............................................................................................................................. 13
3.1.1) Segmentation semi-automatique............................................................................................. 14
3.1.2) Phymul.................................................................................................................................... 16
3.1.3) Algorithme de recalage élastique............................................................................................ 18
3.2) Méthode suivie.............................................................................................................................. 18
3.2.1) Réalisation de modèles géométriques simples........................................................................ 18
3.2.2) Détermination des fibres musculaires du modèle................................................................... 20
3.2.3) Paramétrage des modèles........................................................................................................ 20
3.2.3.1) Elasticité .................................................................................................................... 20
3.2.3.2) Masse......................................................................................................................... 21
3.2.3.3) Viscosité .................................................................................................................... 21
3.2.4) Définition du centre tendineux ............................................................................................... 21
3.2.5) Détermination de la fonction de contraction........................................................................... 22
3.2.6) Recalage.................................................................................................................................. 23
3.2.7) Ajout de la région abdominale et de la cage thoracique......................................................... 23
3.3) Résultats obtenus.......................................................................................................................... 24
3.3.1) Modèle A et modèle B............................................................................................................ 24
3.3.2) Modèle C et modèle D............................................................................................................ 24
3.3.2.1) Analyse qualitative .................................................................................................... 24
3.3.2.2) Analyse quantitative .................................................................................................. 24
a) Variation hauteur zone apposition ......................................................................... 25
b) Variation volume pulmonaire................................................................................ 26
3.3.3) Modèle E................................................................................................................................. 27
3.3.3.1) Analyse qualitative .................................................................................................... 27
2

3.3.3.2) Analyse quantitative .................................................................................................. 27
a) Variation hauteur zone apposition ......................................................................... 28
b) Variation volume pulmonaire ............................................................................... 29
3.3.3.3) Recalage du modèle E ............................................................................................... 29
3.3.4) Modèle F................................................................................................................................. 30
3.4) Discussion...................................................................................................................................... 31
4) CONCLUSION ..................................................................................................... 32
5) BIBLIOGRAPHIE................................................................................................. 33
3

REMERCIEMENTS
Je tiens à remercier toute l’équipe GMCAO pour son accueil et sa sympathie, et en particulier
Emmanuel Promayon pour son encadrement, sa disponibilité et son aide.
Je remercie également David Sarrut du laboratoire LIRIS (Laboratoire d'InfoRmatique en Image et
Systèmes d'information) au centre de lutte contre le cancer Léon Bérard à Lyon, ainsi que tous les
participants de la journée "Etude des déformations du thorax à l’aide de techniques d’imagerie"
Merci encore à Bruno Thibaut, préparateur de la salle d’anatomie de la faculté de médecine, pour ses
précisions issues d’observations de pièces anatomiques du diaphragme.
Et enfin, merci à tous les habitants de la grande salle (thésards, stagiaires…) pour leur sympathie et
leur bonne humeur au quotidien, créant ainsi une ambiance de travail agréable.
Un merci particulier à Elise pour nos discussions et son grain de folie, à Maud pour son sens pratique
et pour ses bulletins météo et merci à Sandrine pour son humour et sa fantaisie.
Merci également à tous les autres avec lesquels j’ai cohabité durant ces six mois de stage.
4

Résumé
Un intérêt croissant est porté depuis quelques années sur les mécanismes de la ventilation et les
recherches ont mis en évidence la nécessité d’établir une technique tri-dimensionnelle (3D) fiable et
non invasive permettant d’estimer l’action des muscles qui composent la pompe inspiratoire et plus
particulièrement le diaphragme.
Dans ce contexte, la modélisation a une place cruciale comme approche permettant la synthèse et
l’intégration de données physiologiques pour ensuite reproduire et prédire les mouvements et les
déformations de l’ensemble des structures anatomiques modélisées.
Dans ce stage, nous présentons et étudions un modèle fonctionnel 3D du diaphragme permettant une
quantification des mouvements basée sur une représentation fonctionnelle du diaphragme. Nous nous
sommes basés sur des données issues de segmentation d’images IRM dynamiques et nous avons
considéré des modèles géométriques simples du diaphragme afin de mettre en évidence les aspects
mécaniques de la contraction, d’évaluer la pertinence de notre méthode de modélisation et de
reproduire le mouvement de piston du diaphragme.
Le modèle final ainsi obtenu fournit d’une part des informations géométriques (déformations 3D des
surfaces diaphragmatiques et calcul de volumes) et d’autre part dynamiques (activité musculaire et
signal d’activation). Ce travail nous a ainsi permis de montrer l’intérêt de notre méthode de
modélisation par rapport à notre problématique, et de dégager d’importants aspects à approfondir dans
de futurs travaux afin d’obtenir un modèle du diaphragme plus performant.
Mots clés : modélisation 3D, simulation, modèle physique discret, respiration, imagerie médicale,
IRM dynamique.
Abstract
Over the last two years, an increasing interest has been turned on the ventilation mechanisms. Several
researches have underlined the need for a reliable, non-invasive three-dimensional (3D) technique to
assess the action of the muscles of the inspiratory pump and more particularly the diaphragm.
In this context, modelling has a crucial place as an approach permitting the synthesis and the
integration of physiological data in order to reproduce and predict motions and distortions of all
modelled anatomic structures.
In this internship, we present and study a 3D functional model of the diaphragm muscle allowing for
motion quantifications based on a functional diaphragm representation. We have used data came from
dynamic IRM images segmentation and we have considered several simplified geometrical models of
the diaphragm in order to illustrate mechanical aspects of the contraction, assess our modelling
method and reproduce the piston motion of the diaphragm.
The final model provides geometrical information (diaphragmatic areas distortions and calculation of
volumes) and dynamic (muscular activity and activation signal).
This work shows the adequacy of our modelling method in regard to our problematic and brings out
important aspects that should be considered in future works towards a more sophisticated model of the
diaphragm.
Keywords : 3D modelling, simulation, discrete physical model, breathing, medical imaging, dynamic
MRI.
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%