PROF SFAXI SALAH / LYCEE BEB IL KHADRA / ANNEE 2020-2021
1
Partie chimie
Exercice N°1
On réalise à la température T1 dans une enceinte de volume V , un mélange comportant
4.10-2 mol de fluorure d’hydrogène (HF) et 4.10-2 mol de (C2O42-) , l’équation qui modélise
cette réaction est :
HF(gaz) + C2O42- F- + HC2O4-
1- a) dresser la tableau descriptif d’évolution de ce système .
b) Exprimer la constante d’équilibre K1 du système en fonction de xf .
c) A l’équilibre , le nombre de mol présent de (HF) est 3,04.10-2mol .
Déterminer la composition en moles du mélange lorsque l’équilibre est atteint .
Calculer la valeur de K1 .
2- On refait l’expérience à la même température , mais avec un mélange contenant
5.10-2 mol de (HF) , 5.10-2 mol de (C2O42-) , 3.10-2 mol des ions fluorure (F-) et
3.10—2mol de (HC2O4-) .
a) Préciser , en le justifiant si le système est en équilibre ou non , si non , indiquer dans
quel sens va –t-il évoluer spontanément ?
b) Déterminer la nouvelle composition du système à l’état d’équilibre .
3- On réalise maintenant l’expérience avec le mélange de la 1ere question mais à une
température T2 , on aboutit dans ce cas à un état d’équilibre dont la constante
d’équilibre est K2=4.10-2.
a) Montrer que la variation de la température de T1 à T2 a provoqué un déplacement de
l’équilibre dans le sens inverse .
b) Déterminer la nouvelle valeur xf’ de l’avancement final de la réaction .
c) Sachant que la réaction dans le sens inverse est exothermique : comparer les deux
températures T1 et T2
Exercice N°2
On donne Ke=10-14 à 25 °C.
1- Recopier et compléter le tableau suivant :
Lycée beb il khadra devoir de maison classe : 4eme sc2
Prof : SFAXI SALAH Matière : SC-PHYSIQUES Coef : 4
durée : 2 heures 2020-2021

PROF SFAXI SALAH / LYCEE BEB IL KHADRA / ANNEE 2020-2021
2
2- Classer les bases par ordre de force de basicité décroissante. Justifier.
3- On fait réagir l’acide cyanhydrique HCN avec la base méthylamine CH3NH2.
a- Ecrire l’équation de la réaction.
b- Etablir l’expression de la constante d’équilibre K de la réaction en fonction de
pKa(HCN) =pKa1 et du pKa(méthylamine)=pKa2. Calculer sa valeur, la réaction est-elle totale
ou limitée ?
Partie physique
Exercice N°1
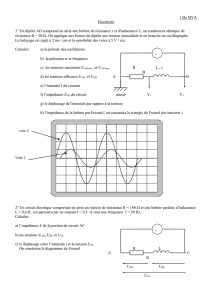
A l’instant de date t=0s , on relie les bornes d’un condensateur initialement chargé à une
bobine d’inductance L et de résistance interne r négligeable . Des oscillations libres non
amorties naissent dans le circuit . On note q(t) la charge de l’armature A ( voir figure) un
dispositif approprié a permis d’enregistrer et de tracer les courbes suivantes :
La tension UAB(t) aux bornes du condensateur en fonction du temps ( fig-1-) .
L’énergie électrostatique Ee(t) en fonction de la Tension UAB(t) ( fig-2-) .
Fig (1) UAB (V) Ee(10-6J)
4
0 8 t(ms)
1- Expliquer la signification oscillations libres et non amorties .
2- a) Etablir l’équation différentielle du circuit régissant la variation de UAB(t) .
b) Donner l’expression de la période propre T0 des oscillations .
c) La solution de l’équation différentielle est de la forme : UAB(t) = UABm.sin(ω0t + φ).
Déterminer les valeurs de UABm , ω0 et φ .
Forme acide
Forme basique
Ka
pKa
Kb
pKb
CN-
5.10-10
HClO
6,5
CH3NH2
5.10-4
0 4
UAB(V)
84,5
338

PROF SFAXI SALAH / LYCEE BEB IL KHADRA / ANNEE 2020-2021
3
d) Déduire l’expression de la force électromotrice d’auto-induction e(t) qui apparait
aux bornes de la bobine .
3- En justifiant la réponse , et en exploitant le courbe de la figure -2- , déterminer la
valeur de :
a) La capacité C du condensateur .
b) L’énergie totale emmagasinée dans le circuit .
c) L’énergie magnétique maximale ELm emmagasinée par la bobine .
4- Exprimer puis calculer la valeur de l’inductance L de la bobine .
1
/
3
100%