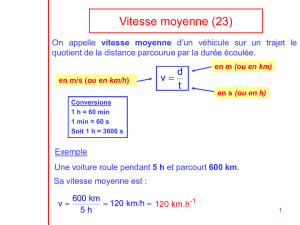
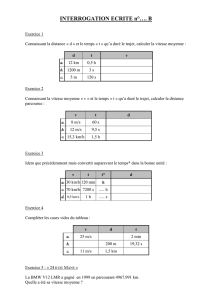
Ex.5 : La thermodynamique des gaz monoatomiques permet d’aboutir aux relations :
𝑃𝑉 =1
3𝑁𝑚𝑣2 𝑒𝑡 𝑈=1
2𝑁𝑚𝑣2=3
2𝑛𝑅𝑇
Avec N le nombre d’atomes du gaz, n le nombre de molécules, m la masse atomique, v la vitesse
efficace et R la constante de gaz parfaits.
1) Retrouver à partir de ces relations l’équation d’un gaz parfait.
2) Exprimer l’énergie interne U en fonction de P et V et en déduire la différentielle dU(P,V).
3) Sachant que 𝑑𝑈 =𝛿𝑄 +𝛿𝑊 𝑎𝑣𝑒𝑐 𝛿𝑄 =𝐶𝑣𝑑𝑇 +𝑃𝑑𝑉 =𝐶𝑝𝑑𝑇 − 𝑉𝑑𝑃
Montrer que 𝐶𝑣 =3
2𝑛𝑅 𝑒𝑡 𝐶𝑝 =5
2𝑛𝑅 et en déduire la relation de Mayer.
Ex.6 : On fait suivre à une mole de gaz parfait les transformations suivantes :
- Une compression isotherme de l’état A(PA,VA,T2) à l’état B(PB,VB,T2) lors de laquelle le gaz
cède une quantité de chaleur Q2,
- Une compression adiabatique de l’état B à l’état C(PC,VC,T1),
- Une détente isotherme de l’état C à l’état D(PD,VD,T1) lors de laquelle le gaz reçoit une
quantité de chaleur Q1,
- Une détente adiabatique de l’état D à l’état A.
1) Tracer le cycle dans le diagramme de Clapeyron (P,V),
2) Déterminer les quantités de chaleur Q1=f(T1,VC,VD) et Q2=f(T2,VA,VB)
On donne 𝛿𝑄 =𝐶𝑣𝑑𝑇 +𝑃𝑑𝑉 =𝐶𝑝𝑑𝑇 − 𝑉𝑑𝑃
Ex.7 : Un gaz parfait de n moles, pour lequel la chaleur spécifique 𝐶𝑣 =5
2𝑅 est pris dans les
conditions du point A de la figure. On lui fait décrire le chemin AB de 3 manières différentes :
1. Le trajet ACB,
2. Le trajet ADB,
3. Le trajet AB directement.
Dans le plan (P,V) avec P2=2P1 et V2=2V1.
On donnera les réponses en fonction de R et T1.
a) Calculer T2 en fonction de T1,
b) Calculer TC en fonction de T1,
c) Calculer TD en fonction de T1.
- Pour le trajet ACB,
a) donner la nature de la transformation (AC) puis calculer WAC et QAC.
b) donner la nature de la transformation (CB) puis calculer WCB et QCB.
c) Calculer WACB et QACB.
- Pour le trajet AB :
a) Calculer la variation de l’énergie interne
∆𝑈
𝐴𝐵 .
b) Calculer WAB.
c) En déduire QAB.
1
/
1
100%