-Généralités
1- Les différents types d’échange de chaleur
On distingue trois types d’échange de chaleur :
• échange par conduction :
Lors d’un transfert thermique par conduction, l’énergie est
transportée de proche en proche, généralement dans un solide,
sans déplacement de matière
• échange par convection :
Lors d’un transfert thermique par convection, l’énergie est
transportée par des mouvements de matière au sein d’un gaz ou
d’un liquide comme dans un radiateur alimenté par de l’eau
chaude
• échange par rayonnement :
Lors d’un transfert thermique par rayonnement, l’énergie
est transportée pardes ondes électromagnétiques donc ce
transfert ne nécessite pas de milieu matériel.
2- Bilan énergétique
Principe de conservation de l’énergie :
Un système est dit isolé s’iln’effectue par de transferts d’énergie
avec d’autres systèmes. Dans ce cas, son énergie totale
(Etot = Em + U) se conserve.
Bilan d’énergie :
La variation de l’énergie totale d’un système au cours d’une évolution
est égale à la somme des travaux des forces extérieures W et des
transferts thermiques Q échangés avec le milieu extérieur :
ΔEtot = ΔEm + ΔU
Par convention,
les transferts d’énergie sont positifs si reçus par le système et négatif si cédés par le
système au milieu extérireur
Si un système ne subit pas de modification de son mouvement et de son altitude,
alors son énergie mécanique ne varie pas, et dans ce cas ΔEtot = ΔU= W + Q
conséquence :dans le cas d’une transformation isochore ΔV= 0 on a ΔU= Q
3-Enceintes adiabatiques
Une enceinte adiabatique est une enceinte imperméable à la chaleur.
Un calorimètre, une bouteille thermos, sont de bonnes enceintes
adiabatiques.
- Une bouteille thermos constitue une enceinte adiabatique.
2 Principe de la calorimétrie
Dans une enceinte adiabatique le corps chaud (C) cède de la
chaleur Q au corps froid (F), jusqu'à l'équilibre thermique :
Q C =-Q F
L’échange de chaleur s’effectue toujours du corps chaud
vers le corps froid.
Remarque :
-L’équilibre thermique est atteint , lorsque les corps sont
Qc
QF

à la même température
- Dans une enceinte adiabatique :ΣQ=0
-Le transfert thermique sans changement d’état physique
1-Expression de la quantité de chaleur
La quantité de chaleur Q échangée par un corps de masse m et de capacité thermique
massique c , lorsque la température varie de i à f sans changer d’état physique est :
Q=m.c.(f-i )
c en J.K-1.Kg-1
Q0 :le corps reçoit de l’énergie thermique de l’extérieur .
Q0 :le corps fournit de l’énergie thermique de l’extérieur .
2-Capacite thermique massique
Definition
La capacité thermique massique c est la quantité d’énergie à apporter par échange thermique
pour élever de 1°C la température de l’unité de masse d’une substance sans changer son état
physique
3-Capacite thermique
La capacité thermique μ est la quantité de chaleur
nécessaire pour élever de 1°C la température de la
masse m sans changer son état physique
Remarque
La capacité thermique d’un système constitue de
plusieurs corps de capacités thermiques μ1 ,μ2 ,……. et μn
est μ=Σμi
4-Applications
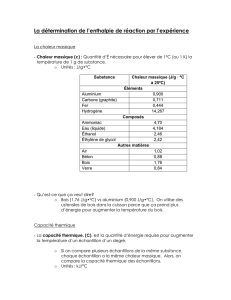
1-Détermination de la valeur en eau d’un calorimètre
Un calorimètre contient une masse m1=250g d'eau. La température initiale de l'ensemble
est 1= 18 °C.
On ajoute une masse m2 = 300 g d'eau à la température 2 = 80 °C.
La température d'équilibre thermique e = 50 °C.
Déterminer la capacité thermique C du calorimètre et de ses accessoires.
Capacité thermique massique de l'eau : ce = 4180 J.kg – 1.K – 1.
Produit
c en J/kg/°C
Eau
4 180
Alcool
2 400
Fer
460
Cuivre
380
Aluminium
920

2-Détermination de la capacité thermique massique d’un metal
On sort un bloc de plomb de masse m1 = 280 g d'une étuve à la température 1 =98 °C.
On le plonge dans un calorimètre de capacité thermique C = 209 J.K – 1 contenant une
masse m2 = 350 g d'eau. L'ensemble est à la température initiale 2 =16°C.
la température d'équilibre thermique est e =17,7 °C.
Déterminer la capacité thermique massique du plomb.
Capacité thermique massique de l'eau : ce = 4180 J.kg – 1.K – 1.
Quantité de chaleur captée par l'eau froide et le
calorimètre : Q1 = (m1 ce e – 1)
Quantité de chaleur cédée par l'eau chaude :
Q2 = m2 ce e – 2)
Le système {eau + calorimètre} est isolé : Q1 + Q2 = 0
Soit (m1 ce e – 1 2 ce e – 2) = 0
e – 1) = – m1 ce e – 1) – m2 ce e – 2)
C = – m1 ce e – 1) – m2 ce (e – 2e - 1
C = m1 ce e – 1) + m2 ce e – 2 1 - e
A.N : C = 130,8 J.K– 1
La capacité thermique du calorimètre est 130,8 J.K– 1.
V-Le transfert thermique avec changement d’état physique
1-
Énoncé
Lorsque un corps de masse m subit un
changement d’état, la quantité de chaleur
Q échangée avec le milieu extérieur est
donnée par la relation :
Q = m.L
La fusion, la vaporisation et la sublimation
nécessitent un apport de chaleur : Q > 0. Les
chaleurs latentes correspondantes Lf, Lv et
Lsub sont positives.
La solidification, la condensation et la resublimation libèrent de la chaleur : Q < 0. Les
chaleurs latentes correspondantes Lsol, Lc et Lres sont négatives. Leurs valeurs absolues sont
les mêmes que pour les transformations inverses respectives :
Lsol = −Lf, Lc = −Lv, Lres = −Lsub.
1
/
3
100%