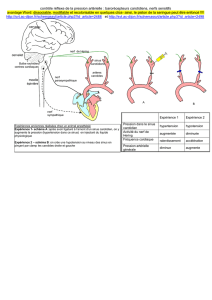
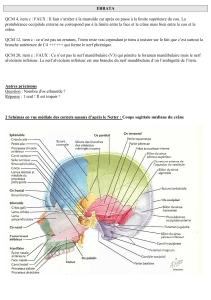
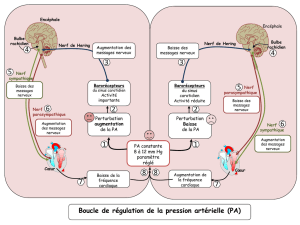
Anatomie du nerf abducens dans les abords des tumeurs du clivus

HAL Id: dumas-00997543
https://dumas.ccsd.cnrs.fr/dumas-00997543
Submitted on 28 May 2014
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-
entic research documents, whether they are pub-
lished or not. The documents may come from
teaching and research institutions in France or
abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est
destinée au dépôt et à la diusion de documents
scientiques de niveau recherche, publiés ou non,
émanant des établissements d’enseignement et de
recherche français ou étrangers, des laboratoires
publics ou privés.
Repérage anatomique du nerf abducens (VI) dans les
abords antérieurs des tumeurs de la région du clivus
Vincent Jecko
To cite this version:
Vincent Jecko. Repérage anatomique du nerf abducens (VI) dans les abords antérieurs des tumeurs
de la région du clivus. Médecine humaine et pathologie. 2013. �dumas-00997543�

1
Année 2013 Thèse n° 3131
THÈSE
Pour l’obtention du
DIPLOME D’ETAT DE DOCTEUR EN MEDECINE
Présentée et soutenue publiquement
Le13 décembre 2013
Par Vincent JECKO
Né le 12 juin 1982 à Talence
Repérage anatomique du nerf abducens (VI) dans les abords
antérieurs des tumeurs de la région du clivus
Directeur de thèse
Madame le Professeur Dominique LIGUORO
Rapporteur de thèse
Madame le Professeur Valérie FRANCO-VIDAL
Membres du Jury
M. le Professeur Vincent DARROUZET ................................................ Président
M. le Professeur Jean-Rodolphe VIGNES .............................................. Examinateur
M. le Professeur Sébastien FROELICH .................................................. Examinateur
M. le Professeur Ludovic LE TAILLANDIER DE GABORY .............. Examinateur
M. le Docteur François SAN-GALLI ..................................................... Examinateur
M. le Docteur Xavier BARREAU ........................................................... Examinateur

2

3
A Monsieur le Professeur Vincent Darrouzet, président du jury
Professeur des Universités
Praticien Hospitalier dans le service de chirurgie ORL, CHU de Bordeaux
Chef de Service de chirurgie ORL du CHU de Bordeaux
Votre simplicité, votre compétence et votre enthousiasme pour l’oto-neuro-chirurgie sont
des exemples à suivre.
Je vous remercie de m’avoir fait l’honneur d’accepter la présidence ce jury de thèse.
A Madame le Professeur Valérie Franco-Vidal, rapporteur de thèse
Professeur des Universités
Praticien Hospitalier dans le service de chirurgie ORL, CHU de Bordeaux
Ta bonne humeur n’a d’égal que ton parcours exemplaire.
Merci pour tes conseils toujours avisés et ton exceptionnelle disponibilité.
A Monsieur le Professeur Jean-Rodolphe Vignes, membre du jury
Professeur des Universités
Praticien Hospitalier dans le service de Neurochirurgie A, CHU de Bordeaux
Votre présence stimulante à nos côtés est toujours précieuse.
Merci d’avoir accepté de juger ce travail après m’avoir maintes fois encadré.
A Monsieur le Professeur Sébastien Froelich, membre du jury
Professeur des Universités
Praticien Hospitalier dans le service de Neurochirurgie de l’hôpital
Lariboisière, Paris
Vous nous faites l’honneur de votre présence. Vous m’avez merveilleusement bien
accueilli. Votre connaissance chirurgicale et votre humanité m’ont profondément marqué.
Je vous remercie d’avoir accepté de juger cette thèse.

4
A Monsieur le Professeur Ludovic Le-Taillandier-de-Gabory, membre du jury
Professeur des Universités
Praticien Hospitalier dans le service de chirurgie ORL, CHU de Bordeaux
Votre pédagogie lors de nos discussions et votre aisance chirurgicale sont un modèle.
Je vous remercie d’accepter de juger cette thèse.
A Monsieur le Docteur François San-Galli, membre du jury
Praticien Hospitalier dans le service de Neurochirurgie A, CHU de Bordeaux
Vous regarder opérer nous fait oublier la difficulté du geste juste. Malgré votre modestie
vous resterez pour beaucoup un exemple inaccessible.
Merci de votre gentillesse et d’avoir accepté de juger ce travail.
A Monsieur le Docteur Xavier Barreau, membre du jury
Praticien Hospitalier dans le service de Neuroradiologie, CHU de Bordeaux
Ta disponibilité et ta compétence ne sont jamais prise à défaut. Ton aide a été précieuse
pour ce travail. Passer dans votre service de neuroradiologie m’aura énormément apporté.
Je te remercie d’avoir accepté de juger ce travail.
A Madame le Professeur Dominique Liguoro, directeur de thèse
Professeur des Universités
Praticien Hospitalier dans le service de Neurochirurgie A, CHU de Bordeaux
Chef de Service de Neurochirurgie A, CHU de Bordeaux
Je n’oublierai jamais votre accueil et votre constant soutien.
Merci pour votre enseignement, votre disponibilité, vos qualités humaines.
Veuillez trouver dans ce travail l’expression de mon profond respect.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
1
/
122
100%