T
le
S
Physique
ChimiePROGRAMME 2012
Livre du professeur
ENSEIGNEMENT SPÉCIFIQUE ENSEIGNEMENT DE SPÉCIALITÉ
Sous la direction de
Mathieu Ruffenach, Thierry Cariat, Valérie Mora
Jennifer Bonnin
Nicolas Courbaize
Magali Darzac
Pierre Fabre
Christophe Feuvrie
Sébastien Firmin
Bastien Gravière
Olivier Krygiel
Guillaume Lozé
Adeline Marois
Sylvie Mellet
Dominique Mercier
Nicolas Nowak
Itala Riahi
Laurent Roure-Atger
Stéphane Serrano
Laurent Toix
Gaël Toussaint
Walter Vassiaux
Cédric Vial
04732977_.indb 1 27/07/12 10:49

SOMMAIRE
ENSEIGNEMENT SPÉCIFIQUE
Partie 1 Ondes et matière
1 Rayonnements dans l’Univers ....................... 6
2 Ondes dans la matière .............................. 12
3 Caractéristiques des ondes .......................... 20
4 Propriétés des ondes ................................ 25
5 Spectres UV-visible et infrarouge .................... 33
6 Spectres RMN du proton ............................ 38
En route vers le Bac ....................................... 45
Évaluation des compétences expérimentales ............... 48
Partie 2 Temps, mouvement et évolution
1 Mouvements et quantité de mouvement ............ 49
2 Champ de force et mouvement ..................... 56
3 Mouvement dans l’espace. . . . . . . . . . . . . . . . . . . . . . . . . . . 64
4 Travail d’une force .................................. 73
5 Transferts énergétiques ............................. 82
6 Temps et relativité restreinte ........................ 92
7 Cinétique chimique ................................. 98
En route vers le Bac ....................................... 106
Évaluation des compétences expérimentales ............... 110
Partie 3 Structure et transformation de la matière
1 Conformations des molécules ....................... 111
2 Chiralité ............................................ 116
3 Les réactions en chimie organique .................. 123
4 Déplacements d’électrons en chimie organique ..... 129
5 Acides et bases ..................................... 136
6 Réactions acido-basiques ........................... 144
En route vers le Bac ....................................... 151
Évaluation des compétences expérimentales ................ 154
Partie 4 Énergie, matière et rayonnement
1 Transferts thermiques ............................... 155
2 Énergie interne ..................................... 162
3 Transferts quantiques d’énergie ..................... 168
4 Dualité onde-particule .............................. 172
En route vers le Bac .......................................... 177
Évaluation des compétences expérimentales ................ 180
04732977_.indb 2 27/07/12 10:49

Partie 5 Les défis du xxie siècle
1 Enjeux énergétiques ................................ 181
2 Chimie et respect de l’environnement ............... 186
3 Contrôle de la qualité par dosage .................... 192
4 Stratégie de la synthèse organique .................. 199
5 Chaîne de transmissions d’informations ............. 206
6 Numérisation d’un signal ............................ 213
7 Images numériques et stockage optique ............ 221
En route vers le Bac .......................................... 227
Évaluation des compétences expérimentales ............... 230
Compléments
Sciences et histoire des arts .............................. 231
Culture scientifique ...................................... 234
ENSEIGNEMENT DE SPÉCIALITÉ
Thème 1 L’eau
1 Eau et environnement .............................. 236
2 Eau et ressources ................................... 243
3 Eau et énergie ...................................... 253
Thème 2 Son et musique
1 Instruments de musique ............................ 259
2 Émetteurs et récepteurs sonores .................... 266
3 Son et architecture .................................. 276
Thème 3 Matériaux
1 Cycle de vie ......................................... 283
2 Structure et propriétés des conducteurs ............. 288
3 Membranes, adhésifs et tensioactifs ................. 297
4 Nouveaux matériaux ................................ 304
© BORDAS / SEJER (2012)
ISBN : 978-2-04-732977-1
04732977_.indb 3 27/07/12 10:49

6Spécifi que – Partie 1 Ondes et matière
séQuence
➙ Enseignement spécifi que, p. 12
PARTIE 1
1
Rayonnements
dans l’Univers
magnétique. Il est donc nécessaire d’utiliser un détec-
teur sensible à ces phénomènes.
L’activité 3 propose de visualiser un rayonnement infra-
rouge en utilisant un détecteur adapté.
SITUATION 3
Les détecteurs astronomiques ne sont pas installés sur
des satellites pour être plus proche des objets célestes à
observer. L’altitude des satellites reste en effet très faible
par rapport aux distances des astres qui nous entourent.
L’utilisation d’observatoires spatiaux s’explique par la
nécessité de s’affranchir des contraintes posées par
l’atmosphère terrestre : absorption de rayonnement,
poussières, turbulence, etc.
L’activité 4 permet de mettre en évidence expérimen-
talement l’absorption de rayonnement.
Activités
ACTIVITÉ 1
Différents rayonnements p. 14
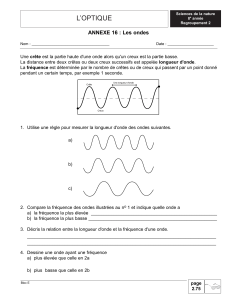
1. a. Une onde peut être représentée par une vague à
la surface de l’eau (cf. figure ci-dessous).
l
Les compétences à acquérir dans la séquence
1. Connaître des sources de rayonnement et leur
utilisation.
2. Comprendre la détection d’un rayonnement.
3. Analyser les conséquences de l’absorption de
rayonnements par l’atmosphère terrestre.
Évaluation diagnostique p. 12
SITUATION 1
La lumière visible est une petite partie de l’ensemble
des rayonnements électromagnétiques que l’on ren-
contre dans l’Univers. Les rayonnements se trouvant
avant 380 nm sont appelés infrarouges et ceux situés
au-delà de 780 nm font partie des ultraviolets.
L’activité 1 présente le spectre électromagnétique
dans son ensemble et montre l’intérêt des observa-
tions dans les différents domaines de rayonnements.
L’activité 2 montre comment il est possible de déduire
des propriétés des sources à partir des rayonnements
qu’elles émettent.
SITUATION 2
La lumière visible peut être détectée par notre œil qui
n’est sensible qu’à cette catégorie de rayonnement.
Les autres rayonnements électromagnétiques se mani-
festent par des variations des champs électrique et
Le programme
Notions et contenus Compétences attendues
Rayonnements dans l’Univers
– Absorption de rayonnements par l’atmosphère terrestre.
– Détecteurs d’ondes (électromagnétiques) et de particules
(photons, particules élémentaires ou non).
–
Extraire et exploiter des informations sur l’absorption de rayon-
nements par l’atmosphère terrestre et ses conséquences sur
l’observation des sources de rayonnements dans l’Univers.
– Connaître des sources de rayonnement radio, infrarouge et
ultraviolet.
– Extraire et exploiter des informations sur :
• des sources d’ondes et de particules et leurs utilisations ;
• un dispositif de détection.
–
Pratiquer une démarche expérimentale mettant en œuvre un
capteur ou un dispositif de détection.
04732977_.indb 6 27/07/12 10:49

7
Spécifique – Séquence 1 Rayonnements dans l’UniversSéquence 1 Rayonnements dans l’Univers
b. Lorsqu’un signal sonore est émis, les diodes initia-
lement éteintes s’illuminent sur l’écran de l’ordinateur
auquel est relié la webcam. L’observation directe de
l’émetteur ne permet pas de voir ce phénomène.
3. a. Un rayonnement est monochromatique quand
sa longueur d’onde ne prend qu’une seule valeur. La
courbe de la figure 2 montre un pic marqué, ce qui cor-
respond à un rayonnement quasi monochromatique.
b. Le pic est centré sur une longueur d’onde de valeur
900 nm.
4. a. La longueur d’onde d’émission des diodes n’ap-
partient pas au domaine de sensibilité du luxmètre.
Cet instrument ne sera donc pas sensible à ce rayon-
nement.
b. L’expérience confirme la réponse précédente.
5. a. Un capteur ne peut pas détecter tous les rayonne-
ments. Il n’est sensible qu’à un intervalle donné de lon-
gueur d’onde appelé : « intervalle de sensibilité spec-
trale ».
b. Le choix d’un capteur est essentiel lors de la détec-
tion des rayonnements. Il est nécessaire de choisir un
capteur, donc l’intervalle de sensibilité correspond aux
types de rayonnement à observer.
ACTIVITÉ 4
Lunettes de soleil p. 17
En utilisant une lampe à vapeur de mercure dont le
spectre présente une raie d’émission à 404 nm (UV
proche). On obtient les spectres suivants :
Fig. A Fig. B
Fig. C
b. La longueur d’onde, notée l, est la distance sépa-
rant deux positions identiques (cf. figure ci-dessus).
2. a. Les noms des différents domaines sont : radio,
infrarouge, visible, ultraviolet, X et gamma.
b.
a : gamma ;
b : X ;
c : ultraviolet ;
d : visible ;
e :
infrarouge ;
f : radio.
3. L’œil humain est sensible aux rayonnements visibles,
ce qui correspond à une très faible portion du spectre
électromagnétique. La majeure partie de ces rayonne-
ments n’est donc pas détectée par notre œil.
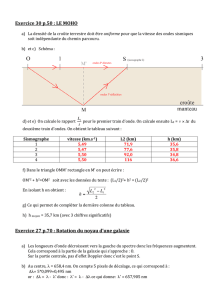
4. a. Ces zones sont le cœur de la galaxie et des étoiles
réparties en spirale autour, dont les contours sont cachés
par les nuages de poussières.
b. Sur la galaxie Andromède, les zones les plus chaudes
sont situées au centre de la galaxie et en certains points
dans le plan de la galaxie.
5. La « lumière invisible » est le nom donné aux rayon-
nements du spectre électromagnétique auxquels l’œil
n’est pas sensible.
ACTIVITÉ 2
Les sources de rayonnements p. 15
1. a.
1
: X ;
2
: ultraviolet ;
3
: visible ;
4
: infrarouge ;
5 : radio.
b. Dans le spectre représenté figure 1, un pic, noté
b,
apparaît dans le domaine visible. Cet astre peut donc
être observé.
2.
a
: rayonnement de freinage – interactions élec-
trons/ions.
c : rayonnement thermique – température élevée.
d : rayonnement synchrotron – interaction électrons/
champ magnétique.
3. a. La courbe
a
est située aux faibles longueurs
d’onde. L’astre est donc entouré d’un nuage de par-
ticules de haute densité. La courbe
c est située dans
une zone de longueur d’onde intermédiaire. L’astre a
une température importante. La courbe
d est située
dans le domaine radio, la vitesse des électrons émis par
l’astre et son champ magnétique sont importants.
b. Le mot « supernova » est utilisé pour qualifier l’ex-
plosion d’une vieille étoile qui éjecte brutalement de
la matière. Sa luminosité augmente alors brutalement.
ACTIVITÉ 3
Casque sans fil p. 16
1. D’après les données techniques, la sensibilité de la
webcam s’étend jusqu’à 1 050 nm, soit dans le domaine
infrarouge. Cet instrument pourra donc détecter les
rayonnements envoyés par l’émetteur.
2. a. Il suffit de placer la webcam en face de l’émetteur
infrarouge et d’observer les diodes en façade.
04732977_.indb 7 27/07/12 10:49
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
 212
212
 213
213
 214
214
 215
215
 216
216
 217
217
 218
218
 219
219
 220
220
 221
221
 222
222
 223
223
 224
224
 225
225
 226
226
 227
227
 228
228
 229
229
 230
230
 231
231
 232
232
1
/
232
100%