N°5 SUJET Toutes les calculatrices de poche, y compris les calculatrices programmables... alphanumériques, dont la surface de base ne dépasse pas 21...

1
EPREUVE FONDAMENTALE DE CHIMIE
Durée : 6 h SUJET N°5
Toutes les calculatrices de poche, y compris les calculatrices programmables et
alphanumériques, dont la surface de base ne dépasse pas 21 cm de long et 15 cm de
large, sont autorisées à condition que leur fonctionnement soit autonome et qu’il ne soit
pas fait usage d’imprimantes.
PREPARATION DE LA 4-METHYLACETOPHENONE
I - MODE OPERATOIRE
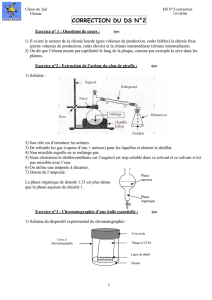
1. Réaction
MONTAGE: ballon tricol de 250 mL
agitation mécanique
ampoule de coulée à pression équilibrée
réfrigérant avec dispositif d’absorption de vapeurs acides
Placer dans le ballon: 37,5 g de chlorure d’aluminium anhydre
64 cm3 de toluène sec
Agiter et couler lentement 12 cm3 d’anhydride acétique: cette opération dure une dizaine de
minutes et la température monte jusqu’aux alentours de 90° C.
Poursuivre la réaction en chauffant le mélange par un bain d’eau bouillante pendant environ 30
minutes. Vérifier par un test simple à la sortie du réfrigérant que la réaction est terminée.
Refroidir le mélange réactionnel à température ambiante.
Le verser dans un mélange contenant 75 g de glace pilée et 80 cm3 d’acide chlorhydrique
concentré. Agiter énergiquement, jusqu’à dissolution du précipité.
2. Séparation
Séparer les phases.
Procéder sur la phase aqueuse à une extraction par 15 cm3 de toluène.
Laver la phase organique avec successivement:
- 20 cm3 d’eau
- puis de la soude à 10 %, jusqu’à pH légèrement alcalin
- puis avec de l’eau
Sécher sur sulfate de magnésium anhydre.
CBR-4/5-94 (5e jour)
Coef.:7

2
3. Purification
Distiller sous pression atmosphérique pour séparer la plus grande partie du toluène.
Terminer par une distillation sous pression réduite : noter la pression, relever la
température en fonction du temps, effectuer les fractionnements nécessaires, recueillir la
4-méthylacétophénone. Toutes les fractions seront présentées au jury.
4. Contrôles
a - Transvaser la 4-méthylacétophénone dans un flacon taré, et la peser.
b - Effectuer une analyse par chromatographie en phase gazeuse de la fraction contenant la
4-méthylacétophénone:
• le chromatographe est réglé pour obtenir une bonne séparation
• les temps de rétention des corps susceptibles d’être présents sont fournis,
• on se limitera à une analyse basée sur une estimation d’après le pourcentage des aires.

3
DONNEES : PROPRIETES PHYSIOUES DES CORPS. TOXICITE. SECURITE
Anhydride acétique
M=102,09 g.mol-1
d420 =1,0820
Eb760 = 139,5° C
soluble dans alcool, éther, benzène. irritant.
AlCl3M= 133,5 g.mol-1
réaction violente avec l’eau.
HCl M=36,5 g.mol-1
d=1,19
pur à 36 % (en masse). irritant, cause des brûlures.
Toluène
M= 92,15 g.mol-1
Eb760 = 110,6° C
Eb14 = 14,5° C
d420 = 0,8669
nD20 = 1,4961
soluble dans l’alcool, l’éther, l’acétone, le benzène. toxique, inflammable
4-méthylacétophénone
Eb760 =225°C
Eb11 =113°C
Eb7=94°C
F= 28°C
d420 =1,0051
nD20 = 1,5335
soluble dans l’alcool, le benzène, l’éther
3-méthylacétophénone
Eb760 = 220°C
Eb12 = 109°C
d420 =1,0070
nD20 = 1,5270
soluble dans l’alcool, l’éther, l’acétone
2-méthylacétophénone
Eb760 = 214° C
Eb12 = 89-92°C
d420 =1,026
nD20 = 1,5276
MASSES ATOMIQUES (en g.mol-1)
C:12 ;H:1 ; O:16

4
II - QUESTIONS
1. Ecrire l’équation bilan de la réaction de synthèse de la 4-méthylacétophénone à partir de
toluène et d’anhydride acétique. Donner le nom de cette réaction et la classer parmi les grands
types de réaction de la chimie organique.
2. Mécanisme réactionnel:
2.1 Préciser le rôle du chlorure d’aluminium.
2.2 Justifier le nombre de moles de chlorure d’aluminium utilisé.
2.3 Ecrire le mécanisme de cette réaction (cf. annexe 1).
3. Prévoir et justifier la composition du produit brut.
4. La rectification se termine par une distillation sous pression réduite.
4.1 Quel est l’avantage de cette technique?
4.2 Quel est dans le cas présent son inconvénient?
4.3 Quel corps pourra être séparé du produit brut?
4.4 Que contiendra probablement le distillat final?
5. Le produit rectifié est analysé par chromatographie en phase vapeur.
5.1 Quel type de colonne peut convenir pour séparer les constituants du mélange? Justifier
ce choix.
5.2 Peut-on prévoir pour cette colonne l’ordre de sortie des corps ? Justifier la réponse.
5.3 Exposer le principe de la méthode d’analyse basée sur le pourcentage des aires.
Critiquer cette méthode.
5.4 En annexe 2 est fourni un chromatogramme montrant la séparation de 4 corps
S,X,Y,Z.
Les résultats sont établis d’après la méthode du pourcentage des aires. On désire
connaître les proportions relatives de X, Y, Z (S étant un solvant). Les résultats affichés
sont-ils convenables pour répondre à cette question ? Justifier la réponse, effectuer s’il y
a lieu une correction.
Pourrait-on programmer cette correction? Si oui, donner le principe.
5.5 Citer d’autres méthodes d’analyse quantitative en chromatographie.
6. Calcul du rendement de la synthèse:
6.1 Justifier les proportions de matières premières mises en oeuvre.
6.2 Calculer la masse théorique de la 4-méthylacétophénone.
6.3 Donner la formule littérale pour calculer le rendement.
7. Spectroscopie : étude des spectres de la 4-méthylacétophénone.
7.1 Interpréter le spectre RMN, et justifier les choix effectués pour l’attribution des signaux
7.2 Interpréter le spectre IR. Quelle région du spectre IR faudrait-il particulièrement
observer pour déceler la présence des isomères de la méthylacétophénone dans le
produit obtenu ?

5
FEUILLE A RENDRE AVEC LA COPIE
RESULTATS PRATIQUES
ASPECT:
MASSE:
RENDEMENT:
4-METHYLACETOPHENONE
PURETE CPV:
RECTIFICATION SOUS PRESSION REDUITE (joindre la courbe annotée)
Fraction N° Pression Température Composition probable
CHROMATOGRAPHIE : Joindre le chromatogramme sur lequel on aura :
• identifié les pics
• encadré les aires calculées par l’intégrateur
• encadré le résultat de l’analyse
RESULTAT : proportion relative de chaque isomère de la méthylacétophénone dans le produit final
ISOMERE %
1
/
5
100%