BTS CHIMISTE EPREUVE FONDAMENTALE DE CHIMIE - Pratique expérimentale -

1/13
BTS CHIMISTE
Session 2009
EPREUVE FONDAMENTALE DE CHIMIE
- Pratique expérimentale -
Durée : 6 heures Coef. : 7
SUJET N°5
PREPARATION DE L’ACIDE 2-IODOBENZOÏQUE ET
REDUCTION DU CAMPHRE PAR LE TETRAHYDRUROBORATE DE SODIUM
Ce sujet comporte deux parties distinctes.
Première partie
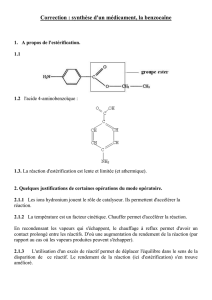
La première manipulation est une réaction de Sandmeyer : synthèse de l’acide 2-iodobenzoïque à
partir de l’acide 2-aminobenzoïque (ou acide anthranilique). Le produit est analysé par CCM.
Deuxième partie
La deuxième manipulation consiste à réduire le camphre en bornéol et isobornéol, par le
tétrahydruroborate de sodium. Le mélange final est analysé par CPG.
Les deux synthèses seront menées simultanément.
I – Mode opératoire
1- Préparation de l’acide 2-iodobenzoïque à partir de l’acide 2-aminobenzoïque
• Dans un réacteur de 250 mL muni d’une agitation magnétique, d’un réfrigérant muni d’un
piège à gaz, d’une ampoule de coulée et d’un thermomètre, introduire progressivement, 5,0 g
d’acide 2-aminobenzoïque, 35 mL d’eau et 10 mL d’acide chlorhydrique concentré.
• Chauffer doucement sous agitation jusqu’à dissolution totale. Refroidir ensuite le mélange
entre 5 °C et 10 °C. Un précipité brun clair apparaît.
• Préparer dans un bécher une solution de 3,0 g de nitrite de sodium dans 10 mL d’eau.
Refroidir cette solution entre 0 et 5 °C.
• Verser cette solution goutte à goutte dans le mélange réactionnel en maintenant la
température en-dessous de 10 °C. A la fin de l’addition, rincer l’ampoule avec 3 mL d’eau
glacée et les introduire dans le réacteur. Cinq minutes après l’addition, vérifier que le test au
papier ioduroamidonné est positif.
• Préparer dans un bécher de 100 mL une solution d’iodure de potassium en dissolvant 9,0 g
d’iodure de potassium dans 15 mL d’eau. Refroidir cette solution jusqu’à une température
inférieure à 10 °C.
• Ensuite, tout en agitant, verser goutte à goutte la solution d’iodure de potassium en
maintenant une température inférieure à 10 °C. Un important dégagement gazeux se produit.

2/13
• Faire chauffer dans un bain d’eau chaude à 70 °C jusqu’à cessation du dégagement gazeux
en agitant vigoureusement (durée maximale du chauffage 20 min).
• Filtrer sur Büchner le produit brut. Le laver avec 30 mL d’une solution d’hydrogénosulfite de
sodium à 12 %, puis abondamment avec de l’eau.
• Verser 80 à 120 mL de solution d’hydrogénocarbonate de sodium pour dissoudre tout le
précipité.
• Ajouter 2 g de charbon actif au filtrat, puis agiter 10 min et enfin filtrer la solution.
• Ajouter une solution d’acide sulfurique diluée au distillat jusqu’à cessation du dégagement
gazeux.
• Filtrer le solide. Laver à l’eau jusqu’à pH = 5-6, puis sécher. Soit m0 la masse de produit brut
humide obtenu.
• Placer la moitié du solide (masse m1) à l’étuve à 80 °C jusqu’à masse constante (masse m1’).
• Le reste (masse m2) est recristallisé dans le mélange eau/éthanol (50/50) (noter le volume V
de mélange utilisé), puis séché à l’étuve. Soit m2’ la masse de produit purifié sec obtenu.
• Contrôler la pureté de l’acide 2-iodobenzoïque synthétisé, en chromatographie sur couche
mince sur plaque de silice. On dépose les solutions à environ 1 % massique dans l’éthanol
des composés suivants :
- l’acide 2-iodobenzoïque brut ;
- l’acide 2-iodobenzoïque purifiée ;
- l’acide 2-iodobenzoïque commercial (solution fournie) ;
- l’acide 2-aminobenzoïque commercial (solution fournie).
L’éluant est un mélange [cyclohexane / acétate d’éthyle (20 / 80) + quelques gouttes d’acide
acétique glacial] ; la révélation se fait sous UV à 254 nm.
• Mesurer la température de fusion du produit synthétisé.

3/13
2- Réduction du camphre en isobornéol
Le camphre utilisé est un mélange racémique. L’équation de réaction avec l’un des
énantiomères est :
O
OH
4 + NaBH4 + 4 EtOH 4 + NaB(OEt)4
Lors de la réduction du camphre par le tétrahydruroborate de sodium, on obtient majoritairement
de l’isobornéol et dans une moindre mesure du bornéol.
Formule du bornéol :
OH
• Dans un réacteur de 250 mL convenablement équipé, introduire 3,00 g de camphre et 15 mL
d’éthanol absolu.
• Agiter à température ambiante jusqu’à dissolution, puis refroidir le mélange réactionnel à une
température comprise entre 5 et 10 °C.
• Ajouter par petite portion 1,50 g de tétrahydruroborate de sodium de façon à ce que la
température reste comprise entre 10 et 15 °C.
• Laisser ensuite le mélange réactionnel 30 min à température ambiante sous agitation.
• Ajouter 10 mL d’eau, puis chauffer à 65 °C au bain-marie pendant 15 min.
• Refroidir le mélange réactionnel, puis transvaser le contenu du réacteur dans une ampoule à
décanter contenant 70 mL d’eau glacée. Traiter la phase aqueuse avec 30 mL d’éther
diéthylique.
• Séparer les deux phases, puis extraire à nouveau la phase aqueuse avec deux fois 20 mL
d’éther diéthylique.
• Laver les phases organiques avec 25 mL d’une solution de chlorure d’ammonium à 15 %.
• Laver deux fois la phase organique avec 20 mL d’eau, jusqu’à pH voisin de 7.
• Sécher la phase organique sur sulfate de magnésium anhydre.
• Eliminer le solvant à l’aide d’un évaporateur rotatif.
• Sécher le solide obtenu à l’étuve à 40 °C. Soit m3 la masse de produit brut obtenu.

4/13
• Analyser le mélange par CPG.
Dissoudre 0,2 g environ de produit brut dans 2 mL d’éthanol et injecter le mélange.
L’analyse quantitative sera faite par la méthode de la normalisation interne (voir annexe, page
13/13). Un chromatogramme de référence (étalon) est fourni par le centre d’examen. On adoptera
les notations suivantes :
• % : pourcentage,
• ét : étalon
• A : surface
• m : masse
• X
camphre, Xbornéol, Xisobornéol : quantité X relative au camphre, au bornéol ou à l’isobornéol.
Grandeurs utilisées
Etalon Echantillon
Pourcentages
surfaciques Pourcentages
massiques Pourcentages
surfaciques Pourcentages
massiques Pourcentages
molaires
%Aétcamphre
%Aétbornéol
%Aétisobornéol
%métcamphre
%métbornéol
%métisobornéol
%Acamphre
%Abornéol
%Aisobornéol
%mcamphre
%mbornéol
%misobornéol
%ncamphre
%nbornéol
%nisobornéol
En déduire les pourcentages massiques %mi du mélange (remplir le tableau de résultats).
Compléter la feuille de résultats.

5/13
II – Données et sécurité
(toutes les températures de changement d’état sont données sous une pression de 1,013 bar)
1- Préparation de l’acide 2-iodobenzoïque à partir de l’acide 2-aminobenzoïque :
Nom Données physico-chimiques Sécurité
Acide sulfurique
M = 98,1 g.mol-1
98 % en masse
d = 1,84
R : 35
S : 26-30-45
Nitrite de sodium
M = 69,0 g.mol-1
E0 (HNO2/NO) = 1,0 V
pKa (HNO2/NO2-) = 3,2
R : 8-25-50 S : 45-61
Acide
2-iodobenzoïque
M = 248,0 g.mol-1
Teb = 160-162 °C
Soluble dans l’éthanol
Soluble dans l’éther diéthylique
R : 22-37/38-41
S : 26-39
Acide
2-aminobenzoïque
(acide anthranilique)
M = 137,1 g.mol-1
Teb = 144-148 °C
Soluble dans l’éthanol
Soluble dans l’éther diéthylique
R : 36
S : 26-36
Hydrogénocarbonate
de sodium
M = 84,0 g.mol-1
Acétate d’éthyle
M = 88,1 g.mol-1
Teb = 77 °C ; d = 0,90
nD20 = 1,3720
R : 11-36-66-67
S : 16-26-33
Ethanol
M = 46,1 g.mol-1
Teb = 78 °C ; d = 0,79
nD20 = 1,3611
Soluble dans l’eau et l’éther
diéthylique
R : 11
S : 7-16
Cyclohexane
M = 84,7 g.mol-1
Teb = 81 °C ; d = 0,78
nD20 = 1,4226
R : 11-38-50/53-65-
67
S : 9-16-25-33-60
Iodure de potassium
M = 166,0 g.mol-1
E0 (I2/I- ) = 0,54 V
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%