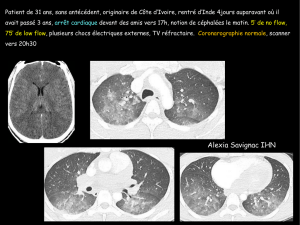
Lire l'article complet

Éditorial
Éditorial
Directeur de la publication
Claudie Damour-Terrasson
Rédacteur en chef
M. Komajda
Rédacteur en chef adjoint
C. Bauters
Rédactrice en chef adjointe (congrès)
N. Baubion
Comité de rédaction
C. Adams - M.C. Aumont - J.P. Batisse
N. Danchin - B. Gallet - X. Girerd
G. Helft - P. Jauffrion - S. Kownator - C. Leclercq
C. Le Feuvre - J.P. Metzger - D. Thomas
Conseiller scientifique : Pr A. Vacheron
Conseil de rédaction
É. Bruckert - J.P. Charliaguet - A. Cohen-Solal
F. Delahaye - P. Gibelin - T. Lavergne
G. Montalescot - R. Roudaut - C. Sebag
Comité de lecture
Prs J.P. Bassand (Besançon) - M. Bertrand (Lille)
M. Bory (Marseille) - M. Brochier (Tours) - J.C. Daubert (Rennes)
J. Delaye (Lyon) - Y. Grosgogeat (Paris)
L. Guize (Paris) - P.G. Hugenholtz (Oosterbeek - Pays-Bas)
H. Kulbertus (Liège) - R. Leighton (Savannah - États-Unis)
J. Lekieffre (Lille) - S. Levy (Marseille) - A. Maseri (Londres)
G. Nicolas (Nantes) - M. Salvador (Toulouse)
Fondateur : Alexandre Blondeau
Société éditrice : EDIMARK SAS
Président-directeur général
Claudie Damour-Terrasson
Rédaction
Directeur délégué de la rédaction : Béatrice Hacquard-Siourd
Secrétaire générale de rédaction : Magali Pelleau
Secrétaire de rédaction : Lauriane Noury
Rédactrices-réviseuses : Cécile Clerc, Sylvie Duverger,
Muriel Lejeune, Catherine Mathis, Odile Prébin
Infographie
Premier rédacteur graphiste : Didier Arnoult
Responsable technique : Virginie Malicot
Rédactrices graphistes : Mathilde Aimée,
Christine Brianchon, Cécile Chassériau, Catherine Rousset
Dessinateurs d'exécution : Stéphanie Dairain,
Antoine Palacio
Commercial
Directeur du développement commercial :
Sophia Huleux-Netchevitch
Directeur des ventes : Chantal Géribi
Directeur d’unité : Nathalie Bastide
Régie publicitaire et annonces professionnelles
Vincent Le Divenach
Tél. : 01 46 67 62 92 – Fax : 01 46 67 63 10
Abonnements
Lorraine Figuière - Tél. : 01 46 67 62 74
2, rue Sainte-Marie, 92418 Courbevoie Cedex
Tél. : 01 46 67 62 00 - Fax : 01 46 67 63 10
E-mail : [email protected]
Site Internet : www.edimark.fr
Photos : © Thierry Maffeis, © Sebastian Kaulitzki.
Ns s d s p ité s
r p it
Ns s d s p ité s
r p it
La Lettre du Cardiologue
3
La Lettre du Cardiologue - n° 400 - décembre 2006
EZETROL®10 mg, comprimé. PRESENTATION ET COMPOSITION (*) : ézétimibe (10 mg) ; croscarmellose sodique, lactose monohydraté, stéarate de magnésium, cellulose microcristalline, povidone (K29-32), laurylsulfate de sodium. INDICATIONS :
-
Hypercholestérolémie primaire :
• EZETROL en association avec une statine (inhibiteur de l’HMG-CoA réductase) est indiqué comme traitement adjuvant au régime chez les patients ayant une hypercholestérolémie primaire (familiale
hétérozygote et non familiale) et qui ne sont pas contrôlés de façon appropriée par une statine seule. • EZETROL en monothérapie est indiqué comme traitement adjuvant au régime chez les patients ayant une hypercholestérolémie primaire
(familiale hétérozygote et non familiale) pour lesquels un traitement par statine est inapproprié ou est mal toléré. –
Hypercholestérolémie familiale homozygote (HFHo) :
• EZETROL en association avec une statine est indiqué comme
traitement adjuvant au régime chez les patients ayant une HFHo. Ces patients peuvent recevoir également des traitements adjuvants (exemple : aphérèse des LDL). –
Sitostérolémie homozygote (phytostérolémie) :
• EZETROL est indiqué
comme traitement adjuvant au régime, chez les patients ayant une sitostérolémie familiale homozygote. - Des études démontrant l’efficacité d’EZETROL dans la prévention des complications de l’athérosclérose ne sont pas encore terminées.
POSOLOGIE ET MODE D’ADMINISTRATION (*) : • Suivre un régime hypolipidémiant adapté pendant toute la durée du traitement. • Prendre un comprimé par jour. • En association à une statine, poursuivre la posologie de la statine utilisée
(cf. RCP de la statine utilisée). • En association à une résine échangeuse d’ions, prendre EZETROL soit >2 heures avant ou >4 heures après celle-ci. • Enfants et adolescents >10 ans : pas d’ajustement posologique mais expérience clinique
limitée. • Enfants < 10 ans : non recommandé. • Sujet âgé/insuffisant hépatique léger/insuffisant rénal : pas d’ajustement posologique. C.T.J. : 1,61 €.CONTRE-INDICATIONS : – Hypersensibilité à la substance active ou à l’un des constituants
du médicament. – En association avec une statine : • Se référer au Résumé des Caractéristiques du Produit de la statine utilisée. • Le traitement par EZETROL est contre-indiqué pendant la grossesse ou l’allaitement. • Le traitement par
EZETROL est contre-indiqué chez les patients présentant une affection hépatique évolutive ou des élévations persistantes et inexpliquées des transaminases plasmatiques. MISES EN GARDE SPECIALES ET PRECAUTIONS PARTICULIERES
D’EMPLOI (*) : – Des cas d’atteinte musculaire et de rhabdomyolyse ont été rapportés. Les patients doivent être informés du risque d’atteinte musculaire. – Si associé à une statine, pratiquer des tests hépatiques en début de traitement et
selon la recommandation pour la statine. – Non recommandé en cas d’insuffisance hépatique modérée ou sévère ou de prise de fibrates. – Prudence en cas de prise de ciclosporine, de warfarine ou d’autres AVK. En raison de la présence de
lactose, ce médicament est contre-indiqué en cas de galactosémie congénitale, de syndrome de malabsorption du glucose et du galactose ou de déficit en lactase. INTERACTIONS AVEC D’AUTRES MEDICAMENTS ET AUTRES FORMES
D’INTERACTION (*) : – Association non recommandée avec les fibrates. – Interaction avec la cholestyramine, la ciclosporine et la warfarine. GROSSESSE ET ALLAITEMENT (*) : – Contre-indiqué en association avec une statine. Ne pas
administrer EZETROL à la femme enceinte (sauf en cas de nécessité absolue) ou allaitante. EFFETS INDESIRABLES (*) :
Etudes cliniques :
– EZETROL administré seul : •
Fréquent :
céphalées ; douleurs abdominales, diarrhée. – EZETROL
associé à une statine : •
Fréquent :
céphalées, fatigue ; douleurs abdominales, constipation, diarrhée, flatulence, nausées ; myalgies. – Biologie : augmentation des transaminases et des CPK. –
Depuis la mise sur le marché :
•
rare :
hypersensibilité
incluant rash, urticaire ; nausées ; hépatite ; arthralgies, myalgies ; augmentation des transaminases et augmentation des CPK. •
très rare :
thrombopénie ; anaphylaxie, angio-œdème ; pancréatite ; lithiase biliaire, cholécystite ;
myopathie/rhabdomyolyse. PROPRIETES PHARMACOLOGIQUES (*) : Classe pharmacothérapeutique : autres réducteurs du cholestérol et des triglycérides. DONNEES ADMINISTRATIVES : Liste I • A.M.M. 362 270-7 : boîte de 28 cps ;
(2003, rév. 06.09.06). Prix : 45,11 €. Remb. Séc. Soc. 65%. – Agréé Collect. • A.M.M. 564 349-3 : boîte de 50 cps ; (2003, rév. 06.09.06) ; Conditionnement exclusivement hospitalier. – Agréé Collect. TITULAIRE DE L’A.M.M. : MSD-SP LTD
– Hertford Road, Hoddesdon – HERTFORDSHIRE EN11 9BU – Royaume-Uni. EXPLOITANT : Laboratoires MERCK SHARP & DOHME-CHIBRET – 3, avenue Hoche
– 75114 PARIS cedex 08 – Tél. 01 47 54 87 00 – Centre d’Information : Tél. 01 47 54 88 00. *Pour une information complète, consulter le dictionnaire VIDAL.
Cette spécialité fait l’objet d’une co-promotion des Laboratoires MERCK SHARP & DOHME-CHIBRET et SCHERING-PLOUGH.
Schering-Plough
* Plus forts ensemble !
Hypercholestérolémie primaire non contrôlée par une statine seule et le régime
11 07 EZT 06F 0285J - Novembre 2006
1er inhibiteur
de l’absorption
intestinale
du cholestérol
Synthèse
hépatique
Agir sur deux
sources du cholestérol
pour plus d’efficacité
® Marque déposée de MSP Singapore Company, LLC
Pour plus d’informations, veuillez consulter le RCP disponible sur le site www.msd-france.com
Quelle prise en charge pour
une cardiomyopathie
hypertrophique en 2006 ?
How to manage hypertrophic cardiomyopathy
in 2006?
En dépit de la meilleure compréhension de la physiopathologie de la
cardiomyopathie hypertrophique (CMH), et notamment des avancées
dans le domaine de la génétique, la prise en charge de la maladie reste
diffi cile et souvent empirique. Les récentes recommandations conjointes de la
Société européenne de cardiologie et de l’American College of Cardiology (Euro-
pean Heart Journal, 2003) ont cependant permis de clarifi er l’attitude vis-à-vis
de cette aff ection, même s’il reste extrêmement diffi cile sur le plan individuel de
chiff rer le risque de mort subite. En l’absence de larges études randomisées, ces
recommandations sont essentiellement fondées sur des études observationnelles.
Les modalités thérapeutiques dépendent des caractéristiques du patient (âge,
facteurs de risque de mort subite), des antécédents familiaux (forme bénigne
ou maligne), de la présence d’un obstacle sous-aortique, de l’importance et de
la distribution de l’hypertrophie ventriculaire gauche (HVG), de la fonction
ventriculaire gauche, de l’importance de la fuite mitrale associée ainsi que des
contre-indications et de la réponse aux médicaments.
MESURES GÉNÉRALES
Dans tous les cas, il faut éviter les efforts violents et les sports de compétition
(l’exercice physique intense étant un mode de déclenchement de la mort
subite chez certains individus), effectuer une prévention anti-oslérienne, et,
dans les formes obstructives, éviter digitaliques, trinitrine ou vasodilatateurs.
L’anticoagulation au long cours doit être systématique en cas de fibrillation
auriculaire, même paroxystique, car le risque thromboembolique est élevé,
notamment lorsque l’oreillette gauche est dilatée. Pour les porteurs sains, chez
lesquels il existe une mutation sur un gène codant pour la maladie mais sans
hypertrophie, une simple surveillance s’impose. Le risque de décès chez ces
patients asymptomatiques semble extrêmement faible. En dehors de ces règles
générales, et schématiquement, il faut distinguer la prise en charge du risque
de mort subite et la prise en charge des symptômes.
PRISE EN CHARGE DU RISQUE DE MORT SUBITE
Plusieurs essais de stratification du risque ont été proposés, toujours imparfaits.
La valeur prédictive individuelle de chaque facteur de risque (tableau) est
faible, de l’ordre de 20 %, en dépit d’une valeur prédictive négative élevée.
Pour certains, la présence d’un critère majeur ou d’au moins trois critères
mineurs de mort subite fait entrer le patient dans la catégorie à haut risque
et doit conduire à discuter l’implantation d’un défibrillateur cardiaque, seule
thérapeutique ayant prouvé son efficacité dans ce domaine. Si l’amiodarone a

Éditorial
Éditorial
4
Porteurs sains
Suivi
Prophylaxie endocardite
Anticoagulation (FA)
Asymptomatique
NYHA I/II
NYHA
III/IV
Échec
Symptômes
réfractaires
sévères
Gradient > 50 mmHg
(spontané/eort) Non obstructive
Abstention ?Bêtabloquant
Vérapamil
Bêtabloquant ou vérapamil
+ Diurétique (remplissage, PTDVG)
Disopyramide
Bêtabloquant + vérapamil
Diurétique, digoxine, bêtabloquant,
spironolactone
Alcoolisation
septale ?
Myectomie*
* Septum interventriculaire > 18 mm Transplantation
DDD
Pacing
Figure. Stratégie de prise en charge (d’après Nishimura RA et Holmes DR,
N Engl J Med 2004).
La Lettre du Cardiologue - n° 400 - décembre 2006
été proposée en cas de tachycardies ventriculaires au Holter,
il paraît difficile de justifier un tel traitement prophylactique
au long cours chez le sujet jeune asymptomatique en raison
de ses effets indésirables et d’une efficacité incertaine.
L’indication du défibrillateur doit prendre en compte le profil
clinique, l’âge, les facteurs de risque identifiés, les niveaux de
risque acceptables pour le patient et sa famille, ainsi que
le contexte socioculturel et économique. Le défibrillateur
est recommandé par la Société européenne de cardiologie
en présence de plus de deux facteurs de risque majeurs de
mort subite (indication de type IIA), tandis que l’amiodarone
constitue une alternative raisonnable en présence d’un seul
facteur de risque majeur (indication de type IIB).
Tableau.
facteurs de risque de mort subite (d’après Nishimura RA et
Holmes DR, N Engl J Med 2004).
Critères majeurs
● Antécédent d’arrêt cardiaque récupéré
● Antécédent de mort subite familiale chez au moins un apparenté du 1er degré
< 40 ans
● Tachycardies ventriculaires soutenues spontanées (> 30 s)
Critères mineurs
● Syncopes inexpliquées (≥ 2 dans l’année)
● Tachycardies ventriculaires non soutenues au Holter (≥ 3 complexes, ≥ 120/mn)
● Absence d’élévation ou chute tensionnelle d’e ort
● HVG échographique > 30 mm
● Obstruction sous-aortique basale > 30 mmHg (si ≥ 40 ans et classe NYHA ≥ II)
● Atteinte microvasculaire coronaire (ischémie documentée en scintigraphie ou
brose en IRM-gadolinium)
● Mutation morbide à haut risque (troponine T cardiaque)
PRISE EN CHARGE DES SYMPTÔMES
De manière très schématique, les symptômes (essentiellement
la dyspnée d’effort) sont grossièrement corrélés à la présence
et à l’importance du gradient sous-aortique et/ou à l’élévation
des pressions de remplissage ventriculaire gauche, paramètres
accessibles en routine par l’échographie doppler cardiaque.
En première intention (figure), il est d’usage de prescrire des
bêtabloquants à forte dose (correspondant à 160-320 mg/j de
propranolol), notamment en cas d’obstacle sous-aortique. Si la
diminution du gradient de repos est inconstante et incomplète,
les gradients provoqués sont habituellement décapités.
L’amélioration fonctionnelle, dose-dépendante, survient chez
30 à 50 % des patients. Le vérapamil (240-480 mg/j) peut être
utilisé si les bêtabloquants sont contre-indiqués, mal tolérés ou
inopérants, sous surveillance étroite, et après s’être assuré que
les pressions de remplissage du ventricule gauche ne sont pas
trop élevées et qu’il n’y a pas de trouble conductif ; le vérapamil
a une efficacité dans environ 50 % des cas, mais avec des
effets indésirables fréquents et parfois graves (25 % des cas).
Le disopyramide (400-800 mg/j) peut être instauré dans les
formes obstructives si ces deux classes pharmacologiques sont
mal tolérées ou inefficaces, parfois associé à un bêtabloquant,
jamais à l’amiodarone, avec une efficacité sur les symptômes
dans deux tiers des cas, et une diminution de 50 % en moyenne
du gradient de repos. L’association bêtabloquant + vérapamil
a été proposée dans certains cas sans preuve d’une efficacité
supplémentaire. L’adjonction d’une faible dose de diurétique
en cas de dyspnée persistante avec pressions de remplissage
élevées peut quelquefois s’avérer utile. En cas de fibrillation
auriculaire, l’amiodarone est efficace pour prévenir les récidives,
et une cardioversion électrique pharmacologique rapide peut
être indiquée dans les formes soutenues mal tolérées. Dans
certains cas, l’ablation du nœud auriculoventriculaire avec
pacemaker définitif est nécessaire.
Dans les formes rebelles au traitement médical maximal
(NYHA III), en présence d’une obstruction sous-aortique de
repos ou d’effort ≥ 50 mmHg, des thérapeutiques invasives
peuvent être discutées, soit la stimulation ventriculaire, soit la
myectomie ou encore l’alcoolisation septale. Ces techniques
concernent environ 5 % des patients atteints.
L’intérêt de la stimulation double chambre (pour préserver
la systole auriculaire, responsable d’au moins 30 % du débit
cardiaque chez ces patients) est actuellement discuté, car il
est difficile de prédire quels patients bénéficieront au mieux
de la technique. De plus, les études randomisées cross-over
ne donnent pas des résultats concordants en ce qui concerne
l’amélioration objective de la capacité d’effort, et, à 4-5 ans,
moins de 40 % des patients continuent à être améliorés sur

Éditorial
Éditorial
5
Lettres - 70 x 176 mm
La Lettre du Cardiologue - n° 400 - décembre 2006
le plan symptomatique. La procédure nécessite un réglage
minutieux du stimulateur par doppler transmitral et semble
plus efficace après 65 ans (amélioration des symptômes dans
deux tiers des cas).
La chirurgie septale (myotomie + myectomie), beaucoup
moins utilisée en France, reste le standard de référence du
traitement invasif de la maladie, notamment aux États-
Unis, en cas d’hypertrophie septale sous-aortique ≥ 18 mm.
L’amélioration des symptômes et de la capacité d’effort
obtenue chez 70 % des patients persiste à long terme, avec
une abolition ou une franche régression des gradients de
repos ou provoqués. La mortalité opératoire reste cependant
élevée dans les centres peu expérimentés.
L’alcoolisation septale partage les indications de la chirurgie
septale. Elle constitue aujourd’hui une alternative à la
myectomie en dépit de l’absence d’études randomisées ou
contrôlées. Elle repose sur l’injection de 1 à 4 ml d’alcool pur
dans la première artère septale après cathétérisme coronaire
sélectif et création d’un infarctus septal entraînant un
remodelage ventriculaire gauche progressif. La diminution
de l’injection de la quantité d’alcool utilisée, de la vitesse
d’injection, et la limitation de la taille de l’infarctus par
utilisation de l’échographie de contraste préprocédure
permettent de limiter la morbidité et la mortalité. Cependant,
la mortalité hospitalière reste élevée (2-4 %), et le recours à
l’implantation d’un pacemaker définitif souvent nécessaire
(> 10 %). La sécurité de la procédure à long terme reste à
préciser, notamment sur le plan rythmique et sur celui de
la contractilité ventriculaire gauche globale, faisant éviter
la technique chez les sujets jeunes. Il existe actuellement
une surprescription de la technique qui, encore une fois, ne
devrait être réservée qu’au patient très symptomatique, sous
traitement médical maximal, avec gradient sous-aortique
≥ 50 mmHg et septum sous-aortique ≥ 18 mm, sans anomalie
structurelle mitrale.
La CMH n’est qu’exceptionnellement une indication à trans-
plantation cardiaque dans les formes non obstructives chez
les sujets jeunes très symptomatiques avec altération de la
fonction systolique.
CONCLUSION
Il faut souligner que l’immense majorité des patients atteints
de CMH ne sont que peu ou modérément symptomatiques,
même s’ils sont obstructifs et à faible risque de mort subite,
avec une espérance de vie proche de celle de la population
générale.
A. Hagège,
pôle cardiovasculaire,
hôpital européen Georges-Pompidou, Paris
1
/
3
100%