07 02 17 16h 16h45 formes vectorise es odou

2016-2017 Les formes vectorisées
Les formes vectorisées (suite du cours)
UE 11- Pharmacie galénique et biopharmacie
Semaine : n°18 (du 06/02/17 au
10/02/17)
Date : 07/02/2017
Heure : de 16h à
16h45 Professeur : Pr. Pascal ODOU
Binôme : n°22 Correcteur : 51
Remarques du professeur
•L2GALE2017 : clé pour moodle
PLAN DU COURS
1/4
I) Les formes contenant des vecteurs nanométriques
II) Les formes contenant des vecteurs nanométriques couplées à des
substances immunogènes vectrices
A) Les immuno-liposomes
1) Pour le pilotage passif
2) Pour le pilotage actif
B) Les nano-vecteurs fonctionnalisés
1) Fonctionnalisation avec des anticorps
2) Fonctionnalisation avec de l'albumine
III) Les formes contenant des substances pathogènes comme vecteur
A) Les vecteurs viraux
B) Les vecteurs à base de toxine

2016-2017 Les formes vectorisées
I) Les formes contenant des vecteurs nanométriques
II) Les formes contenant des vecteurs nanométriques couplées à des
substances immunogènes vectrices
A) Les immuno-liposomes
1) Pour le pilotage passif
Les bases biologiques sont la tendance de certaines cellules (cellules Kupfer du foie, macrophages du SRE) de
phagocyter des particules étrangères, telles que les liposomes. En effet, in vivo les liposomes interagissent aussi
uniquement avec les organes du SRE (foie, rate, poumons, système lymphatique, moelle épinière) qui agissent
pour transformer les particules qu'ils ne reconnaissent pas. Une fois capturés par les macrophages, les liposomes
sont dégradés par les enzymes lysosomiales avec libération cytoplasmique du contenu du liposomes (le PA)
Pour cette raison, les liposomes peuvent être utilisés pour traiter les infections cytoplasmiques graves, difficiles à
éradiquer avec la thérapie conventionnelle. Ils peuvent être utilisés pour traiter par exemple les tumeurs du foie
grâce à la contamination élevée à ce niveau.
2) Pour le pilotage actif
Cela est basé sur la modification des caractéristiques de surface des vésicules liposomiques
Exemples:
•sucres reconnus par les lectines
•galactose ou mannose reconnus par les hépatocytes
Ils peuvent ainsi interagir grâce à un AG exprimé sur la surface. On a un site antigénique, on le réduit en cassant le
pont thiol, on fixe au liposome une molécule d'ancrage ce qui permet de reconnaître les différents récepteurs.
Le cancer, les maladies immunitaires sont des maladies pour lesquelles on peut utiliser cette thérapeutique.
Cependant, l'injection vaut 100 000 à 150 000 euros.
B) Les nanovecteurs fonctionnalisés
1) Fonctionnalisation avec des anticorps
Des systèmes nano-particulaires enrobés par des anticorps monoclonaux ont été proposés pour traiter le cancer. Le
principe est identique à celui vu précédemment avec les liposomes. Des anticorps reconnaissent les antigènes, se
fixent et libèrent le produit.
2) Fonctionnalisation avec l'albumine
Il existe sur le marché une spécialité de Paclitaxel ( l'ABRAXANE ) qui est constitué de nanoparticules de
Paclitaxel lié à de l'albumine sérique humaine. Cette fixation à la surface des nanoparticules permet une
accumulation d'albumine dans les tumeurs solides et dans les zones inflammatoires.
Cette modification a des conséquences cliniques comme on peut le voir puisque :
•la toxicité de cette molécule baisse. La DL50 est augmentée de plus de 50%
•l'efficacité augmente avec une augmentation des concentrations dans les cellules cancéreuses de plus de
30%
III) Les formes contenant des substances pathogènes comme vecteur
A) Les vecteurs viraux
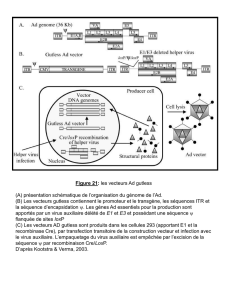
Principe : les virus de part de leur longue évolution et de leur tropisme cellulaire, représentent des outils de choix
pour la thérapie génique. Ils pénètrent spécifiquement et efficacement dans de multiples cellules en utilisant divers
mécanismes. Ensuite, ils s'approprient admirablement la machinerie cellulaire pour exprimer leur patrimoine
2/4

2016-2017 Les formes vectorisées
génétique et se multiplient afin d'infecter d'autres cellules. Cependant les virus sauvages ne peuvent servir
directement à des expériences de vectorisation de traitement, car la plupart d'entre eux sont pathogènes et
dangereux pour l'Homme.
En résumé, on prend un virus, rendu inactif par un virologue, et on utilise la machinerie propre du virus. On enlève
juste la virulence. On ajoute dans ce virus le gène pour produire le médicament et on injecte le virus au patient.
Types de vecteur viral
•les virus adéno-associés (AAV)
Les AAV sont des membres défectueux de la famille des parvovirus. Ils possèdent un simple brin d'ADN et sont
non pathogènes pour l'Homme. Ils sont capables d'infecter à la fois des cellules en division et quiescentes. Ce sont
de petits virus et on peut ajouter des gènes de l'homme pour traiter des maladies génétiques
•les rétrovirus
Les rétrovirus possèdent un patrimoine génétique particulier sous forme de double brin d'ARN, ainsi qu'une
enzyme spécifique. La transcription reverse, ce qui permet le passage de l'ARN à l'ADN proviral. L'intégration
aléatoire de leur génome peut engendre une mutagénèse conduisant à une anomalie du cycle cellulaire ; et activer
des oncogènes.
•les adenovirus
Les adénovirus sont les virus les plus prometteurs dans la vectorisation. Ces virus sont capables d'infecter à la fois
des cellules en division et quiescentes.
•les virus herpétiques
Exemple d'application : Talimogene laherparepvec : intègre fragment d'ADN qui engendre le GM-CSF.
On injecte le virus qui rencontre la cellule cancéreuse. L’herpès va se multiplier, et synthétiser du GM-CSF. La
cellule va éclater sous la stimulation et va libérer les facteurs de croissance et les virus qui se sont répliqués dans la
cellule. Ces virus vont rencontrer d'autres cellules. Si c'est une cellule cancéreuse, on a de nouveau ce cycle mais si
on a une cellule non cancéreuse, le virus va ressortir sans synthétiser le facteur de croissance.
Deux mécanismes d'action
:
•le premier est inhérent(=nécessaire) au mode d'injection, le virus entre dans la cellule tumorale, utilise son
énergie pour se répliquer et finit par la tuer
•le second effectue une modification génétique du virus, qui produit la protéine GM-CSF et stimule le
système immunitaire du patient détruisant les cellules tumorales. L'organisme réagit de manière beaucoup
plus intense et détecte les cellules tumorales cachées
Dans les deux cas, quand la cellule tumorale infectée meurt, les copies du virus modifiées sont libérées dans le flux
sanguin et elles se propagent à davantage de cellules cancéreuses. C'est de cette manière que le virus pourrait avoir
une action diffuse.
Cette technique permet de traiter aussi les lymphomes.
B) Les vecteurs à base de toxine
1) Mode d'action des toxines
T
TOXINE
OXINE
À
À
TRANSPORT
TRANSPORT
ANTÉROGRADE
ANTÉROGRADE
VERS
VERS
LE
LE RE
RE
–L'exotoxine A de Pseudomonas aeruginosa (PE)
–Les toxines ABS
–toxine de Shigella dysenteria d'où son nom de Toxine Shiga
–toxine pertussique de Bordetella pertussis : la toxine de la peste
–toxine Shiga Like d'Escherichia Coli
En théorie, les toxines sont moins toxiques que les virus.
La toxine SHIGA ou shigatoxine : on a la possibilité de soigner des cancers: on prend une toxine qui perfore la
membrane cellulaire et cela va permettre le passage de cette toxine couplée à l'anticancéreux. Des mécanismes
3/4

2016-2017 Les formes vectorisées
vont couper la liaison, libérer la toxine et libérer l'anticancéreux d'ou un effet cytotoxique dans cette cellule.
Aujourd'hui il faut diriger les toxines sur la cellule qui nous intéresse pour avoir une toxicité uniquement sur les
cellules cancéreuses.
T
TOXINE
OXINE
À
À
TRANSPORT
TRANSPORT
ENDOCYTIQUE
ENDOCYTIQUE
:
: LE
LE
FACTEUR
FACTEUR
LÉTAL
LÉTAL
DE
DE B
BACILLUS
ACILLUS
ANTHRACIS
ANTHRACIS
Après liaison à un récepteur membranaire, inconnu à ce jour, ces toxines passent par l'endosome pour être activées
L
L'
'ADÉNYLCYCLASE
ADÉNYLCYCLASE
DE
DE B
BORDETELLA
ORDETELLA
PERTUSSIS
PERTUSSIS
L'adénylcyclase (CyaA) constitue l'une des toxines essentielles de Bordetella pertussis, l'agent de la coqueluche.
4/4
1
/
4
100%