Polyarthrite rhumatoïde : physiopathologie, épidémiologie et imagerie PR

La Lettre du Rhumatologue - n° 308 - janvier 2005
7
PR – PHYSIOPATHOLOGIE, ÉPIDÉMIOLOGIE ET IMAGERIE
Polyarthrite rhumatoïde : physiopathologie,
épidémiologie et imagerie
Rheumatoid arthritis: physiopathology, epidemiology and imaging patterns
J. Morel, B. Fautrel, D. Loeuille
N
Plusieurs travaux montrent l’implication de
l’immunité innée dans l’induction ou la per-
sistance d’une synovite, voire même dans la
destruction ostéo-articulaire, observées dans
la polyarthrite rhumatoïde (PR).
N
Les peptides citrullinés correspondent-ils au
peptide arthritogène ? Les peptides citrullinés
reconnus par les anti-CCP ne semblent pas spé-
cifiquement présents dans la synoviale rhuma-
toïde, suggérant que les anti-CCP seraient le
fruit d’une réponse humorale non spécifique.
NLes antagonistes des chémokines se dévelop-
pent, mais les résultats ne sont pas concluants
pour le moment, démontrant la complexité de
ce système.
NIl existe une tendance à la baisse de l’incidence
de la polyarthrite d’environ 20 à 25 % sur les
25 dernières années ; cette baisse concerne le
sous-groupe des polyarthrites positives pour
le facteur rhumatoïde.
N
Il semblerait qu’il existe une tendance à une
moindre sévérité structurale de la PR au cours
des 40 dernières années ; cette moindre sévérité
pourrait être le reflet d’une optimisation de la
prise en charge thérapeutique, notamment avec
l’introduction de traitements de fond ayant la
capacité de ralentir, voire de bloquer, la pro-
gression des destructions articulaires.
NLa rémission est un objectif possible dans la
PR. L’utilisation des anti-TNFαmultiplie par
trois les chances d’y parvenir.
Points forts
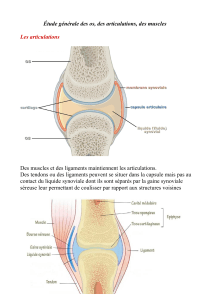
PHYSIOPATHOLOGIE DE LA POLYARTHRITE
RHUMATOÏDE
Rôle de l’immunité innée
La réponse immunitaire innée est la première barrière de
défense mise en jeu par l’organisme pour éliminer des agents
infectieux (bactériens, viraux, fongiques) et des molécules
“danger” (figure 1). Les PAMPs (pathogen associated mole-
cular patterns) sont les antigènes reconnus lors d’une réponse
immunitaire innée. Ces PAMPs sont de natures diverses et se
composent de fragments bactériens membranaires ou
nucléaires (peptidoglycane bactérien, polyI-C, lipopolysac-
charide : LPS, ADN hypométhylé, etc.). Les récepteurs qui
reconnaissent les PAMPs sont appelés les PRRs (Pattern reco-
gnition receptors). Les récepteurs toll like (TLR) appartien-
nent à la famille des PRRs et plusieurs récepteurs toll like ont
été identifiés ainsi que leurs ligands spécifiques (figure 2). Les
récepteurs toll like sont exprimés dans l’articulation rhuma-
toïde. Brentano et al. (1336) ont examiné l’expression en
ARNm de neuf récepteurs toll like (TLR1-9) différents dans
les synoviocytes fibroblastiques de patients atteints de PR,
d’arthrose et de sujets sains (figure 3a). Les récepteurs toll
like
1à 6 sont exprimés dans les synoviocytes fibroblastiques
extraits
de patients atteints de PR. Cette expression n’est cepen-
dant pas spécifique des synoviocytes fibroblastiques rhuma-
toïdes car les récepteurs toll like sont également exprimés dans
les synoviocytes fibroblastiques des sujets sains et des patients
atteints d’arthrose. Toutefois, les synoviocytes fibroblastiques
rhuma
toïdes expriment préférentiellement les récepteurs toll
like 2 et 3
(figure 3b). Les récepteurs toll like peuvent contrô-
ler l’expression de cytokines par les synoviocytes fibroblas-
tiques. En effet, la stimulation des synoviocytes fibroblastiques
par le ligand des récepteurs toll like 2 (peptidoglycane bacté-
rien) induit la production (en ARNm et protéine) des cytokines
pro-inflammatoires IL-8, IL-6 et du facteur proangiogénique
VEGF par les synoviocytes fibroblastiques de PR (Brentano,
1336 ; Lee,1333) (figure 4). L’expression du récepteur toll
like 2 est confirmée en immuno-histologie par Mieke (1334).
Cette expression du récepteur toll like 2 est surtout observée

La Lettre du Rhumatologue - n° 308 - janvier 2005
8
PR – PHYSIOPATHOLOGIE, ÉPIDÉMIOLOGIE ET IMAGERIE
dans la synoviale rhumatoïde alors qu’elle est peu exprimée
dans les synoviales de patients atteints d’arthrose et de sujets
sains. Cette expression de TLR2 est observée au niveau de la
couche bordante et de la couche sous-intimale. Une amplifi-
cation de la réponse inflammatoire par les PAMPs est pos-
sible : Schorr et al. (275) montrent que l’expression des récep-
teurs toll like 2 et 3 sur les synoviocytes fibroblastiques est
augmentée après stimulation par leur ligand respectif (pepti-
doglycan bactérien et polyI-C). L’expression du récepteur toll
like 4 n’est, en revanche, pas modifiée après stimulation par
son ligand (LPS). La stimulation des synoviocytes avec les
ligands des récepteurs toll like 2 et 3 induit aussi la produc-
tion des métalloprotéinases 1, 3, 9 et 13, dont l’implication
dans la destruction cartilagineuse est démontrée (275). L’en-
semble de ces résultats suggère que lors d’une infection, les
récepteurs toll like pourraient être activés et seraient capables
d’induire ou de réactiver une inflammation de la synoviale.
Les fragments de produits bactériens ont également la capa-
cité d’activer la synthèse de gènes contrôlant la production de
métalloprotéinases et pourraient donc intervenir dans la des-
truction ostéo-articulaire observée dans la PR. Les récepteurs
toll like pourraient représenter le lien entre les infections et les
poussées de PR. Les récepteurs toll like semblent également
intervenir dans la physiopathologie d’autres rhumatismes
inflammatoires comme la goutte (Liu-Bryan,524) ou de mala-
dies auto-immunes comme le lupus (Nacionales,151).
Figure 1. Immunité innée : schéma général.
Figure 2. Les toll like receptors :rôle dans
l’immunité innée.
Figure 3. Les toll like receptors sont exprimés dans la synovite rhuma-
toïde.
Figure 4. La stimulation des récepteurs toll like
par leur ligand induit la production de cyto-
kines pro-inflammatoires.
Agents infectieux Molécules “danger”
Cellules présentant l’antigène
Lymphocytes B
Lymphocytes Th1/Th2
Réponse immunitaire innée
(non spécifique de l’antigène) Réponse immunitaire adaptée
(spécifique de l’antigène)
Lymphocytes T régulateurs
Macrophages
Polynucléaires
Complément
Anticorps spécifiques
Diacyl
lipopeptide Bactérie
urinaire
Ds ARN Flagelline Imiquimod CpG ADN
LPS
TLR1
TLR2 TLR2
TLR3
MD2
TLR4 TLR5TLR6 TLR7 TLR9 TLR11
Triacyl
lipopeptide
Peptidoglycanes
TLR2 TLR3 TLR4 TLR5 TLR6 TLR7 TLR8 TLR9TLR1
Seuil de détection
PR
FLS
Arthrose Normal Fibroblastes
cutanés
* p < 0,03
Expression TLR (ARN) (UI)
Expression TLR2 (ARN) (UI)
a
b

La Lettre du Rhumatologue - n° 308 - janvier 2005
9
PR – PHYSIOPATHOLOGIE, ÉPIDÉMIOLOGIE ET IMAGERIE
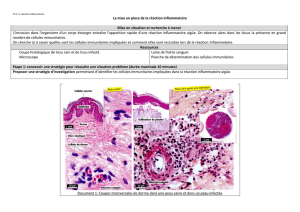
Les peptides citrullinés et les anti-CCP
Les anticorps anti-CCP sont très spécifiques de la PR et ne sont
que rarement retrouvés dans le sérum d’autres rhumatismes
inflammatoires. Une question reste actuellement sans réponse :
les anti-CCP sont-ils le résultat d’une réponse immunitaire spé-
cifique dirigée contre le peptide arthritogène et, en l’occurrence,
un peptide citrulliné présent dans l’articulation ? Ou sont-ils,
comme pour les autres auto-anticorps, la signature d’une réponse
immunitaire non spécifique ?
Une réponse immunitaire spécifique pourrait être favorisée par
un excès d’expression de peptides citrullinés au niveau de la syno-
viale rhumatoïde. Un polymorphisme de la peptidyl-arginine déi-
minase (PAD) 4 pourrait favoriser une surexpression de peptides
citrullinés dans la synoviale rhumatoïde. Cette surexpression
pourrait favoriser une réponse immunitaire spécifique restreinte
par les molécules HLA-DR et dirigée contre ces peptides citrul-
linés. Une autre hypothèse privilégie la formation de complexes
immuns synoviaux, comme avec d’autres auto-anticorps, qui
entraîneraient une réponse immunitaire humorale non spécifique
(figure 5). Vossenaar et al. (1361) ont dosé les anti-CCP dans
le liquide et ont recherché la présence de peptides citrullinés dans
le tissu synovial de 23 patients atteints de PR et de 31 patients
atteints d’autres rhumatismes inflammatoires (rhumatismes
microcristallins, spondylarthropathies). Les anticorps anti-CCP
sont présents uniquement dans le liquide synovial des patients
atteints de PR et absents dans celui des rhumatismes inflamma-
toires non PR. Elkayam et al. (303) trouvent des résultats très
comparables avec un taux d’anti-CCP nettement plus élevé dans
le liquide synovial de la PR (343,6 ± 505 unités) que dans le
liquide synovial de patients atteints de rhumatisme psoriasique
(49,5 ± 33,3) ou d’arthrose (36,8 ± 53,7). Vossenaar a également
réalisé un immunomarquage avec du tissu synovial de ces patients
PR/non PR avec des anticorps anti-CCP purifiés à partir du sérum
de patients atteints de PR, mais aussi avec des anticorps spéci-
fiques des peptides citrullinés (anticorps anti-A2-2 et anti-RA3)
obtenus à partir d’une banque de données. Les anticorps anti-
CCP mais aussi les anticorps anti-A2-2 et anti-RA3 détectent des
peptides citrullinés dans la synoviale rhumatoïde et non rhuma-
toïde (figure 6). Les peptides citrullinés sont donc présents dans
la synoviale des rhumatismes inflammatoires, qu’ils soient rhu-
matoïdes ou non. Cette non-spécificité des anti-CCP pour le tissu
synovial rhumatoïde n’est pas en faveur d’une réponse humorale
spécifique. Cependant, cette hypothèse est discutée par de Rycke
et al. (1362), qui ont dosé le taux d’anti-CCP dans le sérum et le
liquide synovial et ont comparé ces taux à la présence de pep-
tides citrullinés dans la synoviale de 61 patients atteints de PR.
Le taux d’anti-CCP dans le sérum et le liquide synovial est cor-
rélé à la présence de l’épitope partagé et de peptides citrullinés
dans la synoviale, avec des taux d’anti-CCP plus élevés en cas
de présence de ces deux facteurs. Cette corrélation entre la pré-
sence de l’épitope partagé, la présence de peptides citrullinés et
le taux des anticorps oriente plutôt vers une réponse
humorale
spécifique restreinte par les molécules HLA de classe II
. On peut
regretter dans ce travail l’absence de contrôle non PR.
Un polymorphisme au niveau de PAD4 pourrait expliquer l’ex-
cès de citrullination des peptides au niveau de la synoviale. Dans
une étude japonaise, un polymorphisme de PAD4 en position 94
a été associé à la PR. Cette équipe (Kuwahara,852) confirme
ce résultat à partir d’échantillons individuels obtenus sur la base
de 704 patients atteints de PR et de 960 sujets sains (tableau I).
Ce polymorphisme n’a pas été retrouvé associé à la PR dans une
population anglaise. Par ailleurs, Constantin (856) a étudié le
polymorphisme de PAD4 chez 173 PR. Aucun des polymor-
phismes de PAD4 n’est associé à la présence des anti-CCP, ni à
la sévérité radiologique de la PR. Le polymorphisme de PAD4
n’est pas non plus associé à la présence de peptides citrullinés au
niveau de la synoviale, ni au taux sérique d’anticorps anti-CCP
chez 59 patients atteints de PR (Cantaert,1369). L’ensemble de
Figure 6. Les peptides citrullinés sont présents
dans la synoviale des différents rhumatismes
inflammatoires... même non rhumatoïdes.
Figure 5. Anti-CCP : témoins d’une réponse immunitaire spécifique ou
non spécifique ? A:un polymorphisme de PAD4 peut augmenter l’ex-
pression de peptides citrullinés dans la synoviale. B:réponse immunitaire
spécifique, restreinte par HLA-DR, dirigée contre les peptides citrullinés.
C:formation d’immun-complexes (IC) synoviaux non spécifiques.
Peptide (arginine)
Lymphocytes T
Macrophage
Plasmocytes
IC
A
C
B
FcγR
HLA-DR
Macrophage
ou polynucléaire
Peptides
citrullinés Cellules
dendritiques
Anticorps
anti-CCP
Peptidylarginine
déiminase (PAD 4)
Cytokines pro-
inflammatoires
Anti-CCP
Synoviale PR
Synoviale non PR
IgG contrôle Anti-A2-2 IgG contrôle

La Lettre du Rhumatologue - n° 308 - janvier 2005
10
PR – PHYSIOPATHOLOGIE, ÉPIDÉMIOLOGIE ET IMAGERIE
ces résultats ne permet pas de retenir le polymorphisme de PAD4
comme un facteur essentiel dans la production de peptides citrul-
linés et dans la formation d’anti-CCP, du moins dans les popu-
lations européennes de PR.
Les chémokines
Cette année, de nombreuses communications ont concerné les ché-
mokines. L’importance des chémokines dans le recrutement des
cellules inflammatoires dans la synoviale est démontrée. Le récep-
teur CCR2 et son ligand MCP-1 sont considérés comme des cibles
potentielles dans le traitement de la PR. Leur inhibition pourrait
empêcher le recrutement des leucocytes dans la synoviale et empê-
cher ainsi le développement de la synovite. Un essai clinique dans
la PR utilisant un anticorps monoclonal dirigé contre la chémo-
kine MCP-1 a été présenté par Haringman et al. (519),mais avec
des
résultats décevants car les patients traités par l’inhibiteur de MCP-
1
ont une aggravation de leur polyarthrite. Cet effet pourrait être
lié soit à l’anticorps lui-même, soit à un déséquilibre du gradient
de concentrations en chémokines MCP-1 entre le sang et la syno-
viale aboutissant au final à un recrutement plus important de leu-
cocytes dans la synoviale. L’inhibition du récepteur de chémokine
CCR2 dans la PR est supposée améliorer l’arthrite, mais le concept
ne semble pas aussi simple. En effet, Quinones et al. (1111) mon-
trent que les souris de souche DBA et BALB/c déficientes pour
CCR2 (CCR2-/-) ont une infection persitante après injection de
Mycobacterium avium intracellulaire alors que les souris généti-
quement non modifiées guérissent de l’infection au bout de 6 à 8
semaines. Les souris DBA CCR2-/- développent une arthrite qui
ressemble beaucoup à la PR avec une augmentation des anticorps
anticollagènes. Ces résultats montrent que l’absence de CCR2 peut
donc favoriser une réponse auto-immune entraînant une réaction
croisée contre le collagène aboutissant au développement d’une
arthrite chronique. Ces résultats montrent qu’il existe un équilibre
complexe entre les chémokines, et incitent à la prudence dans l’uti-
lisation d’un inhibiteur de CCR2 dans la PR.
J. Morel
ÉPIDÉMIOLOGIE
Incidence de la polyarthrite rhumatoïde :
la tendance est à la baisse
Une étude de la Mayo Clinic aux États-Unis avait surpris, il y a
quelques années, en rapportant une décroissance de la fréquence de
la PR entre la fin des années 1950 et le milieu des années 1990 (1).
Ces résultats semblent confirmés par une étude épidémiologique
conduite en Finlande dans cinq hôpitaux de district, représentant
une population d’un peu plus d’un million d’habitants adultes
(Kaipiainen-Seppänen,1230). Sept cent quatorze nouveaux cas
de rhumatismes inflammatoires ont été identifiés durant l’année
2000, dont 321 PR selon les critères de l’ACR (FR+ dans deux
tiers des cas). L’incidence annuelle calculée s’établit à 29,1 pour
100 000 habitants, plus forte chez les femmes (35,7 pour 100
000) que chez les hommes (20,5/100 000). Comparativement aux
chiffres des années 1980, 1985, 1990 et 1995, on observe une
baisse de 20 à 25 % de l’incidence de la PR, quel que soit le sexe
(p < 0,01) (figure 7) ; la baisse est plus marquée pour les PR FR+.
Moins fréquent, et peut-être aussi moins grave…
Le pronostic de la PR s’améliorerait selon une analyse conduite
d’après les données de la National Data Bank for Rheumatic
Disease (NDBRD, Wichita [KS], États-Unis). Chez 3 900 PR
suivies sur 5 ans, il est noté une tendance à un moindre handi-
cap fonctionnel, évalué à partir de l’indice HAQ ; cette amélio-
ration semble à mettre sur le compte des traitements anti-TNFα
(Wolfe,361).
Cette hypothèse est soutenue par un autre travail, qui a évalué la
sévérité structurale de la PR à partir d’une douzaine de cohortes
constituées au cours des 40 dernières années (Sokka,1840). Dans
chacune de ces cohortes, l’atteinte structurale (pincements des
interlignes ou érosions) était évaluée soit par le score de Larsen,
soit par celui de Sharp. Pour en permettre la comparaison, cette
atteinte était exprimée en pourcentage du score maximal possible.
Ainsi, il est noté que, à durée égale, l’atteinte structurale est
moindre dans les cohortes de patients atteints d’une PR ayant
débuté dans les années 1990 par rapport à celles constituées avant
1980 (tableau II). Faut-il voir là les conséquences d’une meilleure
prise en charge de la maladie grâce à des traitements plus effi-
caces ? Il est tentant de le penser mais la preuve reste à faire.
Tableau II. Sévérité de l’atteinte structurale de la PR dans les cohortes
des 40 dernières années (Sokka, 1840).
Période de début des PR Atteinte structurale à différents termes
dans les cohortes (exprimée en % du score maximum possible)
5 ans 10 ans 20 ans
1960-1980 (5 cohortes) 20-30 % 30-40 % 40-60 %
1980-1990 (5 cohortes) 10-20 % 15-30 % - -
1990 et après (4 cohortes) 5-11 % - - - -
Tableau I. Polymorphisme du gène PAD4 dans la PR.
PR (n = 704) Contrôle (n = 960) Chi2 p Odds-ratio
PAD 494 0,45 0,40 8,53 0,035 1,23
Figure 7. Baisse de l’incidence de la PR en Finlande durant les 20 der-
nières années (Kaipiainen-Seppänen, 1230).
70
60
50
40
30
20
10
0
1980
Femmes toutes PR
Femmes PR FR + Hommes toutes PR
Hommes PR FR +
Incidence/100 000
1985 1990
Années
1995 2000

La Lettre du Rhumatologue - n° 308 - janvier 2005
11
PR – PHYSIOPATHOLOGIE, ÉPIDÉMIOLOGIE ET IMAGERIE
Rémission de la PR : un objectif à la portée des trai-
tements modernes
Depuis quelques années, les essais contrôlés montrent qu’il est
possible d’obtenir une rémission de la PR chez certains patients.
Hors des essais, dans des populations de patients moins sélec-
tionnés, la fréquence de telles rémissions était moins claire.
Au sein d’une cohorte hospitalière américaine de 331 PR – 118
(36 %) étant traitées par anti-TNFα–, la fréquence des rémissions
était globalement de 18,3%, plus élevée chez les patients sous
anti-TNFα
α(25,2 %) (Liang,371). Dans une seconde étude, issue
d’un registre épidémiologique norvégien rassemblant 2 125 PR –
dont 382 (18 %) traitées par anti-TNFα–, cette fréquence était
globalement de 15,3 % et de 13,3 % chez les patients sous anti-
TNFα(Kvien,973). Après ajustement sur l’âge, le sexe, l’an-
cienneté de la PR, sa gravité et les traitements antérieurs, les deux
études montraient que les patients sous anti-TNFαavaient envi-
ron trois fois plus de chances d’être en rémission que ceux trai-
tés par des traitements conventionnels (tableau III).
B. Fautrel
IMAGERIE DE LA POLYARTHRITE
RHUMATOÏDE
Le bilan radiographique fait partie des examens indispensables au dia-
gnostic et à l’évaluation structurale des patients atteints de PR. C’est
un examen de réalisation facile qui permet d’analyser en quelques
minutes l’évolution de la maladie. Le score de Sharp modifié par
D. Van der Heijde fait office de score de référence pour juger l’action
structurale des traitements de fond utilisés dans la PR. Cependant, ce
score ne permet pas de dépister les signes d’inflammation présents dès
le début de la maladie. L’imagerie par résonance magnétique (IRM)
et, plus récemment, l’échographie permettent le diagnostic de syno-
vites et de ténosynovites et la mise en évidence d’érosions dont le
nombre est deux à trois fois plus important qu’en radiographie. Ces
examens présentent donc des avantages incontestables pour établir le
diagnostic précoce de rhumatismes inflammatoires. Cependant, et pour
des raisons différentes, ces moyens d’imagerie ne sont utilisés qu’en
seconde intention. En effet, l’IRM pèche par son accessibilité limitée,
l’absence de véritables consensus pour suivre les patients, et des dif-
ficultés à avoir un score reproductible suffisamment sensible aux chan-
gements pour qu’elle soit utilisée à la place du bilan radiographique.
L’échographie permet un examen en temps réel du patient, une appré-
ciation de l’inflammation articulaire, mais réclame un temps d’exa-
men important et souffre d’un déficit de reproductibilité. De plus,
aucun consensus n’est actuellement défini pour déterminer quelles
articulations doivent être ciblées aux mains et aux pieds. Ce congrès
a permis d’apporter quelques éléments de réponse. En effet, Ejbjerg
et al.
(322)
ont montré, chez 35 sujets atteints de PR et 9 sujets contrôles
évalués à t = 0 et à un an, qu’une approche IRM restreinte (étude d’une
main avec une séquence pondérée T1 et injection de gadolinium) ou
multi-articulaire (étude avec des séquences pondérées T2 des mains
et des poignets ainsi que de l’un des pieds) permettait de dépister 2,7
à 3 fois plus de sujets progresseurs que le score de Sharp. Epsen et al.
(324)
ont par ailleurs montré que l’analyse de clichés IRM du poignet
et des mains, pour la synovite, les érosions et l’œdème spongieux, par
des lecteurs rompus à cette technique, permettait d’établir un score
RAMRIS (score proposé par l’OMERACT) reproductible, dont la dif-
férence minimale détectable (smallest detectable difference :SDD) est
de 2,92 pour la synovite, de 4,92 pour les érosions et de 3,62 pour l’œ-
dème. Cette SDD est inférieure ou égale à celle du score de Sharp
(SDD = 5). En échographie, une étude intéressante a été présentée par
Scheel et al.
(326)
qui ont démontré chez les patients atteints de poly-
arthrite que l’examen du versant palmaire permettait de retenir le dia-
gnostic de synovite dans près de 86 % des articulations inflammatoires
en ultrasons. Les auteurs confirment qu’une approche semi-quantitative
est préférable à une approche quantitative de mesure de la synovite, et
montrent que l’atteinte prédomine sur les articulations métacarpo-
phalangiennes
(MCP) par rapport aux articulations interphalangiennes
proximales (IPP). Un seuil de significativité de 0,6 mm d’épaisseur
pour le diagnostic de synovite est par ailleurs retenu. Pour finir, Scheel
et al. ont montré que parmi six combinaisons testées et comparées à
un examen IRM, l’étude du versant palmaire des articulations MCP
et IPP des doigts II-IV était la plus fiable et la plus performante. Fina-
lement, ces auteurs ont confirmé que l’IRM bas champ (0,2 Tesla) et
l’échographie permettaient de suivre l’efficacité des traitements par
anti-TNF (adalimumab) sur de petites articulations en démontrant une
diminution d’épaisseur de la synovite (Scheel,980) (figure 8).
D. Loeuille
Bibliographie
1. Doran MF, Pond GR, Crowson CS, O’Fallon WM, Gabriel SE. Trends in inci-
dence and mortality in rheumatoid arthritis in Rochester, Minnesota, over a forty-
year period. Arthritis Rheum 2002;46:625-31.
Tableau III. Fréquence des rémissions de la PR en pratique courante
(Liang, 371 ; Kvien, 973).
Fréquence Tous DMARD Anti-TNFαOR ajusté [IC
95
]
des rémissions Anti-TNFα
versus autres
DMARD
États-Unis (critères de Pinals) 18,3 % 25,2 % 2,7 [1,4-5,3]*
Norvège (DAS 28) 15,3 % 13,3 % 3,0 [1,7-5,4]**
Figure 8. Réduction de la synovite à 3 mois en IRM et en échographie.
Score IRM de synovite Score US de synovite
24
20
16
12
8
4
0
24
20
16
12
8
4
0
À l’inclusion À 3 mois
À l’inclusion À 3 mois
*Ajustement sur l’âge, le sexe, l’ethnie, la durée de la maladie, les traitements antérieurs.
** Ajustement sur l’âge, le sexe, la durée de la maladie, le DAS initial, les FR, le caractère
érosif, les traitements antérieurs.
1
/
5
100%