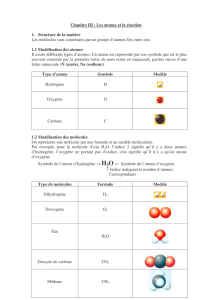
Nomenclature Chimie Organique

Nomenclature Chimie Organique
Alkanes
n-alcanes - Préfixes
Chaîne Principale
Chaîne latérale
1
méthane
méthyl-
2
éthane
éthy-
3
propane
propyl-
4
butane
butyl-
5
pentane
pentyl-
6
hexane
hexyl-
7
heptane
heptyl-
8
octane
octyl-
9
nonane
nonyl-
10
decane
decyl-
20
eicosane
eicosyl-
30
triacontane
triacontyl-
On distingue les atomes de carbone par le nombre d’autres
atomes de carbone auxquels ils sont liés.
➔primaire: lié à 1 (ou 0) atomes de carbone
➔secondaire: lié à 2 atomes de carbone
➔tertiaire: lié à 3 atomes de carbone
➔quaternaire: lié à 4 atomes de carbone

isopropyl-
tertiobutyl-, tertbutyl-, t
-butyl-
phényl-
Hydrocarbures Saturés Ramifiés
1. Trouver la plus longue chaîne d’atomes de carbone. *
2. Identifier et nommer les chaînes attachées à la chaîne principale.
3. Numéroter la chaîne principale tel que l’indice de la première ramification est le plus petit que
possible. **
4. Placer les désignations des chaînes latérales, précédées de leur indice, devant le nom de la chaîne
principale. On utilise l’ordre alphabétique (di-, tri-, tetra- exclus mais iso-, cyclo-, tert- inclus)
En cas d’ambiguité:
* S’il y a plusieurs chaînes de la même longueur que la
chaîne “la plus longue”, celle avec le plus grand nombre de
chaînes latérales est choisie.
3-éthyl-2-méthylhexane
non pas: 3-isopropylhexane
** Si les extrêmités de la chaîne principale ont des
ramifications equidistantes, on considère la prochaine
ramification et ainsi de suite (first point of difference rule). Si
tous les indices sont égaux, on commence du côté du
groupe cité en premier lieu (ordre alphabétique)
4,5-dibromo-2,2-dichlorohexane
non pas: 2,3-dibromo-5,5-dichlorohexane
car: 2,2,4,5 est mieux que 2,3,5,5

Halogénures
F-
fluoro-
Cl-
chloro-
Br-
bromo-
I-
iodo-
Cyclanes
pentane
cyclopentane
propyl-
cyclopropyl-
Exemple
1-bromo-5-chloro-4-cyclopropyl-3-isopropyl-1,2-diméthylcyclohexane

Isoméries
Cahn-Ingold-Prelog
1. Comparer nombre atomique Z des atomes de premier rang.
2. Faire une liste ordonnée par nombre atomique des atomes fixés en deuxième lieu. Règle de la
première différence.
3. Continuer de façon analogue pour les atomes fixés en troisième lieu et ainsi de suite.
N.B.: Les atomes liés par liaison double ou triple sont comptées deux respectivement trois fois.
Exemple:
On compare les deux groupements liés au groupement R:
En haut
En bas
C
C
O,O,C
O,O,C
O,O,H
O,H,H,H,H
Donc le groupement en haut a une plus grande priorité que celui en bas.
E (entgegen), Z (zusammen)
Le systéme E, Z est utilisé s’il y a des liaisons doubles.
1. En utilisant les règles de Cahn-Ingold-Prelog, trouver à chaque bout de la liaison double le
groupement à plus grande priorité.
2. Si les groupements se trouvent du même côté, il s’agit de l’isomérie Z, sinon E
3. Le nom de la molécule est précédée par (#E)- ou (#Z)- où # est l’indice de la liaison double.

(2E)-2-bromo-3-chlorobut-2-ène
(1Z)-prop-1-ène-1,2-diol
cis, trans
Dans un cyclane avec deux substituants, on utilise cis
si les substituant se trouvent du même côté du plan du
cycle, et trans
s’il se trouvent de part et d’autre.
S’il y a plus que deux substituants, on cherche, en utilisant les règles de Cahn-Ingold-Prelog, le substituant de
plus haute priorité attaché a chacun des deux carbones voisins. Ces deux substituants décident s’il s’agit d’un
isomère cis
ou trans
cis-1,2-dichlorocyclohexane
trans-1,2-dichlorocyclehexane
trans-1-bromo-1,2-dichlorocyclohe
xane
R, S
Le systèle R, S est utilisé pour distinguer isomères des molécules comportant un ou plusieurs atomes chiraux.
Deux molécules qui sont images l'une de l'autre dans un miroir et non superposables sont dites
énantiomères.
Pour préciser la configuration d’un atome de carbone asymétrique dans un composé:
1. Classer les 4 atomes ou groupements selon le système CIP.
2. Tourner la molécule tel que l’atome ou le groupement le moins prioritaire soit dirigé vers l’arrière.
3. Si la priorité des 3 autres atomes ou groupements décroît dans le sens de la rotation des aiguilles
d’une montre, la configuration est désignée par R, sinon la configuration est désignée par S.
4. Le nom de la molécule est précédée par (#R)- ou (#S)- où # est l’indice de l’atome chirale..
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%