Le point sur les morpholinos

© 2007 - AFM – Association Française contre les Myopathies
Source : www.afm-france.org
Auteur : F. Dupuy-Maury
Le point sur les morpholinos
Le morpholino est un ARN antisens synthétisé en laboratoire. Il sert à bloquer, ou au
contraire à faciliter, la production d’une protéine par un gène.
Un peu d’histoire
Conçus à la fin des années 1990 par James E. Summerton de la société Gene Tools, LCC,
les morpholinos ont été développés pour une utilisation chez l’Homme en collaboration avec
la société américaine pharmaceutique AVI Biopharma Inc.
Dans un premier temps, les morpholinos ont servi à bloquer certains gènes dans des cellules
ou des animaux, notamment le poisson zèbre, afin de “mimer” des maladies. Aujourd’hui, ils
sont également utilisés pour des applications thérapeutiques.
Comment agissent les morpholinos ?
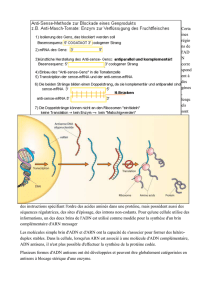
Le gène est une petite partie de la molécule d’ADN du chromosome, contenue dans le noyau
des cellules et écrite avec un alphabet de quatre lettres, les bases : Adénine (A), Cytosine
(C), Thymine (T) et Guanine (G). Le gène peut donc être comparé à une phrase qui
contiendrait toutes les instructions permettant la production de la protéine. Or, cette phrase
est morcelée : il existe des fragments codants — « exons » — et des non-codants —
« introns » — qui se succèdent tour à tour jusqu’au bout du gène. Dans un premier temps,
quand la cellule reçoit l’ordre de produire la protéine, toute la phrase du gène correspondant
est transcrite en pré-acide ribonucléique messager, ou pré-ARNm. Cette molécule, suite de
bases comme l’ADN, est la “copie” fidèle de l’ensemble du gène. Lors de l’étape suivante,
appelée épissage, le pré-ARNm perd ses introns. Il ne reste plus que les exons « collés » les
uns derrière les autres qui forment l’acide ribonucléique messager ou ARNm.

© 2007 - AFM – Association Française contre les Myopathies
source : www.afm-france.org
Auteur : F. Dupuy-Maury
Ensuite, ce dernier quitte le noyau et rejoint le cytoplasme de la cellule.
Il est alors pris en charge par le ribosome. Ce traducteur « glisse » le long de
l’ARN messager afin de traduire le texte, écrit par la série d’exons, en acides aminés dont
l’assemblage donne la protéine.
Les ARN antisens, dont les morpholinos, sont des petits bouts d’ARN qui interviennent au
moment de l’épissage. En se collant à des endroits donnés du pré-ARN messager issu d’un
gène, ils font passer des bouts codants pour des éléments non-codants à éliminer. Ainsi
bernée, la machinerie cellulaire donne naissance à un ARN messager dont le texte — les
exons collés les uns aux autres — est incomplet. Si le texte incomplet obtenu est
intraduisible par le ribosome, la protéine normalement codée par le gène n’est pas produite.
Les ARN antisens portent alors bien leur nom. Cependant, ils peuvent aussi redonner du
sens à des gènes dont la “phrase” de départ est en partie erronée par une anomalie
génétique. C’est ce que les initiés appellent le “saut d’exon”. Dans ce cas, l’élimination du
bout codant mais gênant lors de l’épissage permet d’obtenir un texte certes incomplet mais
traduisible par le ribosome. De fait, la protéine obtenue est plus petite que la normale mais
au minimum partiellement fonctionnelle.

© 2007 - AFM – Association Française contre les Myopathies
source : www.afm-france.org
Auteur : F. Dupuy-Maury
Les applications thérapeutiques dans la myopathie de Duchenne
Actuellement, les pistes thérapeutiques impliquant les morpholinos pour les maladies
neuromusculaires concernent la myopathie de Duchenne. Dans ce cas, c’est la capacité des
morpholinos à entraîner des sauts d’exon qui est utilisée. L’objectif des scientifiques est
d’engendrer chez les malades une dystrophine plus courte mais fonctionnelle.
Un essai dans les starting-blocks
A ce jour, le projet le plus avancé est celui mené par le consortium britannique MDEX (le
consortium MDEX a été formé en 2005 pour développer et évaluer des traitements de
thérapie génique pour la myopathie de Duchenne) en collaboration avec la société AVI
Biopharma Inc qui fournira les morpholinos. En effet, ces médecins s’apprêtent à débuter un
essai chez 9 enfants, âgés de 12 à 17 ans, affectés par la myopathie de Duchenne. Cet
essai dont l’investigateur principal est Francesco Muntoni, pédiatre au Hammersmith
Hospital de Londres, n’apportera pas de bénéfice direct aux patients. En revanche, il a pour
objectifs de vérifier l’absence de toxicité de l’injection dans le muscle de morpholinos et
d’évaluer la capacité de ces derniers à restaurer, à l’endroit de l’injection, une dystrophine

© 2007 - AFM – Association Française contre les Myopathies
source : www.afm-france.org
Auteur : F. Dupuy-Maury
plus courte. En pratique, les 9 patients seront séparés en 3 groupes ; chaque groupe
recevant une dose croissante de morpholinos. De fait, le 3
e
groupe ne sera traité que si les
deux doses plus faibles se révèlent inefficaces pour la production de la dystrophine.
L’évaluation de celle-ci se fera grâce à l’analyse de la biopsie musculaire de la zone traitée.
A l’heure où nous écrivons, l’essai est prêt à débuter.Il n’attend plus que le feu vert de la
Medicines and healthcare products regulatory agency, l’équivalent britannique de l’Afssaps
(Agence française de sécurité sanitaire des produits de santé), ce qui est, aux dernières
nouvelles, en bonne voie.
Des recherches prometteuses
En janvier 2006, des chercheurs britanniques, américains et australiens ont montré
l’efficacité de l’injection en intraveineuse de morpholino chez des souris mdx, c’est-à-dire
modèles de la myopathie de Duchenne (Systemic delivery of morpholino oligonucleotide
restores dystrophin expression bodywide and improves dystrophic pathology, Nature
Medicine, publication en ligne du 29 janvier 2006). Cependant, ces équipes ont noté que les
morpholinos n’atteignent pas le cœur ce qui est une limite conséquente du traitement dans la
mesure ou le cœur n’est pas épargné par la maladie.
Plus récemment, lors du colloque sur les goulets d’étranglement organisé par l’AFM au
Génocentre d’Evry en janvier dernier, Shin’ichi Takeda du Centre national de neurologie et
de psychiatrie de Tokyo (Japon) — qui travaille en collaboration avec Terry Partridge et Eric
Hoffman du Children’s National Medical Center de Washington (Etats-Unis) — a présenté
des résultats d’un traitement à base de morpholinos chez un chien modèle de la myopathie
de Duchenne. Le chien, jeune adulte, a reçu 5 injections de morpholinos une fois par
semaine administrées par voie sanguine dans une patte arrière. Deux mois après les
injections, les chercheurs ont observé une dystrophine plus courte mais fonctionnelle dans
tous les muscles, à l’exception du cœur, et une meilleure performance du chien à la course
par rapport à ses homologues non-traités. Actuellement, deux autres chiens sont en cours
de traitement.

© 2007 - AFM – Association Française contre les Myopathies
source : www.afm-france.org
Auteur : F. Dupuy-Maury
Avantages et inconvénients des morpholinos
D’autres ARN antisens et d’autres techniques pour effectuer des sauts d’exons sont à
l’étude. Alors, pourquoi utiliser les morpholinos ?
Plus efficaces et plus stables
Par rapport aux autres ARN antisens comme ceux qui sont actuellement évalués par l’équipe
de Judith van Deutekom du Leiden University Medical Center (Pays-Bas) en collaboration
avec la société hollandaise Prosensa, « les morpholinos sont plus stables que leurs
homologues et sont toujours présents 16 semaines après leur injection, » indique Francesco
Muntoni. Entendez par là que les morpholinos sont moins sensibles aux enzymes, c’est-à-
dire aux protéines, qui dégradent les autres ARN antisens. Ainsi, les doses de morpholinos
nécessaires pour atteindre en quantité suffisante les cellules musculaires sont a priori plus
faibles et les administrations successives moins fréquentes.
Pas de réaction immunitaire
L’autre piste explorée pour le saut d’exon s’appuie sur un petit gène, U7, dont le produit
fonctionne comme un ARN antisens. Ce procédé est actuellement étudié par l’équipe de Luis
Garcia de l’Institut de Myologie, soutenue par l’AFM, chez des chiens modèles de la
myopathie de Duchenne. Les résultats sont encourageants mais pour amener le gène U7
aux cellules, il faut utiliser un virus, AAV, ce qui engendre des réactions immunitaires. De ce
point de vue, l’avantage des morpholinos est de ne ressembler ni de près, ni de loin à un
virus ou plus simplement à une protéine, ils passent donc totalement inaperçus du système
immunitaire.
Déjà utilisés chez l’Homme
Enfin, les morpholinos produits par AVI Biopharma ont déjà été injectés à plus de
250 patients sans engendrer d’effets secondaires indésirables, pour le traitement de
maladies coronariennes et de l’hépatite C. Dans ce cas, l’effet recherché n’est pas
l’obtention d’une protéine ; au contraire puisque les chercheurs veulent bloquer la production
de protéines “nuisibles”. Pour autant, ces essais chez l’Homme montrent leur absence de
toxicité.
 6
6
1
/
6
100%